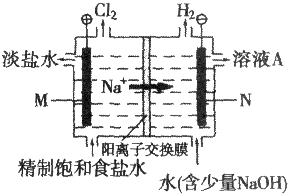
题目内容
12.A-J均为中学化学中常见物质,C、D、G、H、I常温下均为气体,且G为单质,C常参加光合作用,其中H和I为大气污染物,E为常见的无色液体.F的焰色反应为黄色,反应①、②、③为工业反应.固体A是一种化肥,产物C、D、E的物质的量之比为1:1:1.它们之间的转化关系如图:
(1)写出A的化学式NH4HCO3,B的电子式为
 ,B中含有的化学键类型是离子键、共价键.
,B中含有的化学键类型是离子键、共价键.(2)写出反应①的化学方程式4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)少量J溶液加入F的水溶液中发生反应的离子方程式为CO32-+H+=HCO3-.
(4)氯气遇到D会产生大量白烟,常用D的浓溶液检验氯气管道是否漏气.其发生反应化学方程式为8NH3+3Cl2=6NH4Cl+N2.
(5)将G和I的混合气体60mL通入水中,充分反应后余下气体10mL(在相同条件下测定),则混合气体中G和I的体积比为1:2或1:9.
分析 气体化合物C常参加光合作用,与固体B反应得到F与G,G为气体单质,F的焰色反应为黄色,则F含有Na元素,应是过氧化钠与二氧化碳的反应,故B为Na2O2,C为CO2,F为Na2CO3,G为O2,固体A是一种化肥,加热分解得到C、D、E的物质的量之比为1:1:1,E为常见的无色液体,E为H2O,D能与氧气连续反应,且反应①、②、③为工业反应,可推知A为NH4HCO3,D为NH3,H为NO,I为NO2,J为HNO3,据此解答.
解答 解:气体化合物C常参加光合作用,与固体B反应得到F与G,G为气体单质,F的焰色反应为黄色,则F含有Na元素,应是过氧化钠与二氧化碳的反应,故B为Na2O2,C为CO2,F为Na2CO3,G为O2,固体A是一种化肥,加热分解得到C、D、E的物质的量之比为1:1:1,E为常见的无色液体,E为H2O,D能与氧气连续反应,且反应①、②、③为工业反应,可推知A为NH4HCO3,D为NH3,H为NO,I为NO2,J为HNO3.
(1)A的化学式为NH4HCO3,B为Na2O2,电子式为 ,含有离子键、共价键,
,含有离子键、共价键,
故答案为:NH4HCO3; ;离子键、共价键;
;离子键、共价键;
(2)反应①的化学方程式为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)少量J(HNO3)溶液加入F(Na2CO3)的水溶液中发生反应的离子方程式为:CO32-+H+=HCO3-,
故答案为:CO32-+H+=HCO3-;
(4)氯气遇到NH3会产生大量白烟,常用NH3的浓溶液检验氯气管道是否漏气.其发生反应化学方程式为:8NH3+3Cl2=6NH4Cl+N2,
故答案为:8NH3+3Cl2=6NH4Cl+N2;
(5)若氧气剩余,由4NO2+O2+2H2O=4HNO3可知,参加反应的NO2为(60mL-10mL)×$\frac{4}{5}$=40mL,故氧气为60mL-20mL,则混合气体中氧气与二氧化氮体积之比为20mL:40mL=1:2,
若剩余气体为NO,由3NO2+H2O=2HNO3+NO,可知该反应中NO2为10mL×3=30mL,反应4NO2+O2+2H2O=4HNO3中NO2为(60mL-30mL)×$\frac{4}{5}$=24mL,故氧气为60mL-24mL-30mL=8mL,则混合气体中氧气与二氧化氮体积之比为6mL:(24mL+30mL)=1:9,
故答案为:1:2或1:9.
点评 本题考查无机物的推断,物质的状态、焰色反应、特殊反应是推断突破口,需要学生熟练掌握元素化合物知识,难度中等.

| A. | 淀粉、纤维素、油脂、蛋白质都是高分子化合物,都能发生水解反应 | |
| B. | CH2Cl2只有一种结构说明甲烷分子是正四面体结构,而不是平面正方形结构 | |
| C. | 煤通过干馏可得到焦炭、煤焦油、焦炉气、粗氨水等 | |
| D. | 油脂皂化反应的产物是高级脂肪酸盐和甘油 |
| A. | 原子种类由质子数和中子数共同决定 | |
| B. | 质子数相同的粒子一定属于同种元素 | |
| C. | 元素的性质主要由元素原子的最外层电子数决定 | |
| D. | 同位素的物理性质有差别而化学性质几乎完全相同 |
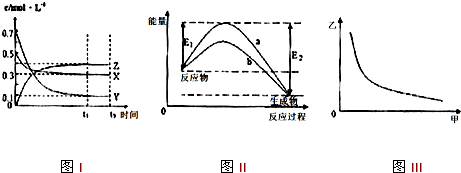
| A. | 该反应的化学方程式为X(g)+3Y(g)?2Z(g) | |
| B. | 图Ⅲ中甲表示压强,则纵坐标可表示混合气体中Z的含量或者混合气体的平均摩尔质量 | |
| C. | 若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图Ⅱ中曲线可表示有无催化剂的能量变化曲线 |
 偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是( )
偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是( )| A. | BaTiO3 | B. | BaTi8O12 | C. | BaTiO4 | D. | BaTi8O4 |
| A. | 淀粉、油脂、蛋白质都能水解,其产物均不相同 | |
| B. | 用高锰酸钾溶液除去混在乙炔中的少量乙烯 | |
| C. | 通过银镜反应可以区分甲醛和乙醛 | |
| D. |  用图所示实验装置制取交纯净的乙酸乙酯 |

 ,1mol A完全燃烧消耗9mol O2.
,1mol A完全燃烧消耗9mol O2. .
. ,下列有关叙述正确的是( )
,下列有关叙述正确的是( )