题目内容
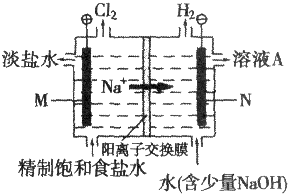
17.某种氢氧燃料电池的电解液为KOH溶液,下列有关电池的叙述不正确的是( )| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 该燃料电池的总反应方程式为:2H2+O2═2H2O | |
| C. | 工作一段时间后,电解液中的KOH的物质的量不变 | |
| D. | 工作时溶液中K+向负极移动 |
分析 氢氧燃料碱性电池中,通入氢气的一极为电池的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,反应的总方程式为2H2+O2=2H2O,据此分析解答.
解答 解:A.该原电池中,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-═4OH-,故A正确;
B.正极反应为O2+2H2O+4e-=4OH-,负极反应为H2-2e-+2OH-=2H2O,则总反应式为:2H2+O2=2H2O,故B正确;
C.根据电池反应式知,KOH不参加反应,所以KOH的物质的量不变,故C正确;
D.放电时,阳离子钾离子向正极移动,故D错误;
故选D.
点评 本题考查化学电源新型电池,为高频考点,所有的燃料电池中负极上都是燃料失电子发生氧化反应,难点是电极反应式的书写.

练习册系列答案
相关题目
7.X、Y、Z是三种气态物质,在一定温度下其变化符合如图.下列说法不正确的是( )


| A. | 该反应的化学方程式为X(g)+3Y(g)?2Z(g) | |
| B. | 图Ⅲ中甲表示压强,则纵坐标可表示混合气体中Z的含量或者混合气体的平均摩尔质量 | |
| C. | 若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图Ⅱ中曲线可表示有无催化剂的能量变化曲线 |
5.已知CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206kJ/mol
CH4(g)+CO2(g)═2CO(g)+2H2 (g)△H=+247kJ/mol
C-H键的键能约为413kJ/mol,O-H键的键能约为463kJ/mol,H-H键的键能约为436kJ/mol,则CO2中C=O键的键能约为( )
CH4(g)+CO2(g)═2CO(g)+2H2 (g)△H=+247kJ/mol
C-H键的键能约为413kJ/mol,O-H键的键能约为463kJ/mol,H-H键的键能约为436kJ/mol,则CO2中C=O键的键能约为( )
| A. | 797.5 kJ/mol | B. | 900.5 kJ/mol | C. | 962.5 kJ/mol | D. | 1595 kJ/mol |
12.氮元素的单质和常见的化合物在工、农业生产中用途广泛.
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是N2.
(2)雷雨时空气中的N2转化为NO,生成物NO是无色的气体,难(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应.NO2与水反应的化学方程式为3NO2+H2O=2HNO3+NO.
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气.
①制取氨气的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;加热\;}}{\;}$CaCl2+2H2O+2NH3↑;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为10.7g.
(4)已知:4NH3+6NO$\frac{\underline{\;催化剂\;}}{\;}$5N2+6H2O.化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.

若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同).
①NH3与稀硫酸溶液反应的离子方程式为NH3+H+=NH4+;;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是溶液显色所需时间.
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
| N2 | O2 | Ar | CO2 |
| -196°C | -183°C | -186°C | -78°C |
(2)雷雨时空气中的N2转化为NO,生成物NO是无色的气体,难(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应.NO2与水反应的化学方程式为3NO2+H2O=2HNO3+NO.
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气.
①制取氨气的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;加热\;}}{\;}$CaCl2+2H2O+2NH3↑;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为10.7g.
(4)已知:4NH3+6NO$\frac{\underline{\;催化剂\;}}{\;}$5N2+6H2O.化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.

若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同).
①NH3与稀硫酸溶液反应的离子方程式为NH3+H+=NH4+;;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是溶液显色所需时间.
9.下列说法中,正确的是( )
| A. | 天然气的主要成分是乙烯 | |
| B. | 煤焦油分馏可以获得多种芳香烃 | |
| C. | 石油的裂化和裂解都属于物理变化 | |
| D. | 天然气、沼气都属于可再生的清洁能源 |
6.短周期中元素a、b、c在周期表中位置如图所示,下列有关这三种元素的叙述中正确的是( )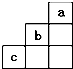

| A. | b的氢化物很稳定 | |
| B. | a是一种活泼的非金属元素 | |
| C. | c的最高价氧化物的水化物是一种弱酸 | |
| D. | b元素在化合物中的最高价为+7价 |
7.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
| A. | AlCl3和NaOH | B. | NaAl02和H2S04 | C. | Na2C03和HCl | D. | NaHS04和Ba(OH)2 |
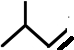 ;
;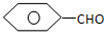 ;
;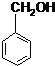 (写出名称):苯甲醇
(写出名称):苯甲醇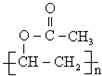 (写出单体的结构简式)CH3COOCH=CH2
(写出单体的结构简式)CH3COOCH=CH2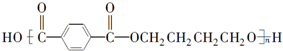 (写出单体的结构简式)
(写出单体的结构简式) 、HO-CH2-CH2-CH2-CH2-OH.
、HO-CH2-CH2-CH2-CH2-OH.