题目内容
15.有关海带中碘元素的分离实验,下列说法中正确的是( )| A. | 海带、紫菜等海藻类植物中含有丰富的I2 | |
| B. | 灼烧海带样品时,坩埚应该垫在石棉网上加热 | |
| C. | 可以用CCl4、裂化汽油等有机溶剂把碘萃取出来 | |
| D. | 分液漏斗中液体的总体积不得超过其容量的$\frac{2}{3}$ |
分析 A、海带、紫菜等海藻类植物中含有丰富的碘元素;
B、坩埚可以直接加热;
C、裂化汽油含有不饱和键,能与碘发生加成反应;
D、分液漏斗中液体体积不能超出容器容积的三分之二.
解答 解:A、海带、紫菜等海藻类植物中含有丰富的碘元素,不是碘单质,故A错误;
B、坩埚可以在酒精灯上直接加热,无须垫石棉网,故B错误;
C、裂化汽油中含有不饱和双键,能与碘发生加成反应,故不能作萃取剂,故C错误;
D、分液漏斗中液体体积不能超出容器容积的$\frac{2}{3}$,故D正确,故选D.
点评 本题主要考查的是碘元素的存在以及实验室常见操作和常见仪器的使用,难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
5.某芳香族化合物的分子式为C8H6O2,它的分子(除苯环外不含其他环)中不可能有( )
| A. | 一个醛基 | B. | 一个羧基 | C. | 两个羟基 | D. | 两个醛基 |
6. 研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.
(1)用稀土等催化剂能将汽车尾气中的CO、NOx碳氢化合物转化成无毒物质,从而减少汽车尾气传染.已知:
N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式:2NO (g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ/mol.
(2)还可以用活性炭还原法处理氮氧化物,反应为C(s)+2NO(g)?N2(g)+CO2(g)H.向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应的平衡常数K=0.25(保留两位小数).
②前10min内用v(NO)表示的化学反应速率为0.0042mol/(L.min);30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是降低CO2浓度.
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2浓度之比为3:1:1,则该反应的△H<0(填“>”“=”或“<”).
(3)①用气体传感器可以检测汽车尾气中CO的含量.传感器是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.a为负极,电极反应式为CO-2e-+O2-═CO2.电池工作过程中,O2-由b极(填“a”或“b”,下同)移向a极.
②欧IV型汽车认证和生产一致性排放限值:汽油机CO1.00g/km.某测试车检测过程中,每行驶1km传感器中通过电子为0.08mol,则该车不符合(填“符合”或“不符合”)欧IV排放标准.
 研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.(1)用稀土等催化剂能将汽车尾气中的CO、NOx碳氢化合物转化成无毒物质,从而减少汽车尾气传染.已知:
N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式:2NO (g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ/mol.
(2)还可以用活性炭还原法处理氮氧化物,反应为C(s)+2NO(g)?N2(g)+CO2(g)H.向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |
②前10min内用v(NO)表示的化学反应速率为0.0042mol/(L.min);30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是降低CO2浓度.
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2浓度之比为3:1:1,则该反应的△H<0(填“>”“=”或“<”).
(3)①用气体传感器可以检测汽车尾气中CO的含量.传感器是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.a为负极,电极反应式为CO-2e-+O2-═CO2.电池工作过程中,O2-由b极(填“a”或“b”,下同)移向a极.
②欧IV型汽车认证和生产一致性排放限值:汽油机CO1.00g/km.某测试车检测过程中,每行驶1km传感器中通过电子为0.08mol,则该车不符合(填“符合”或“不符合”)欧IV排放标准.
3.下列说法不正确的是( )
| A. | 原子种类由质子数和中子数共同决定 | |
| B. | 质子数相同的粒子一定属于同种元素 | |
| C. | 元素的性质主要由元素原子的最外层电子数决定 | |
| D. | 同位素的物理性质有差别而化学性质几乎完全相同 |
7.X、Y、Z是三种气态物质,在一定温度下其变化符合如图.下列说法不正确的是( )
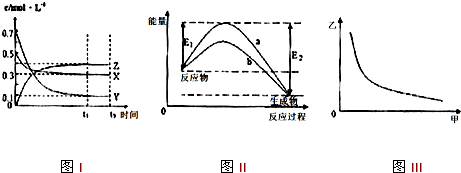

| A. | 该反应的化学方程式为X(g)+3Y(g)?2Z(g) | |
| B. | 图Ⅲ中甲表示压强,则纵坐标可表示混合气体中Z的含量或者混合气体的平均摩尔质量 | |
| C. | 若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图Ⅱ中曲线可表示有无催化剂的能量变化曲线 |
4. 偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是( )
偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是( )
 偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是( )
偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是( )| A. | BaTiO3 | B. | BaTi8O12 | C. | BaTiO4 | D. | BaTi8O4 |
5.已知CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206kJ/mol
CH4(g)+CO2(g)═2CO(g)+2H2 (g)△H=+247kJ/mol
C-H键的键能约为413kJ/mol,O-H键的键能约为463kJ/mol,H-H键的键能约为436kJ/mol,则CO2中C=O键的键能约为( )
CH4(g)+CO2(g)═2CO(g)+2H2 (g)△H=+247kJ/mol
C-H键的键能约为413kJ/mol,O-H键的键能约为463kJ/mol,H-H键的键能约为436kJ/mol,则CO2中C=O键的键能约为( )
| A. | 797.5 kJ/mol | B. | 900.5 kJ/mol | C. | 962.5 kJ/mol | D. | 1595 kJ/mol |


 ,1mol A完全燃烧消耗9mol O2.
,1mol A完全燃烧消耗9mol O2. .
.