题目内容
16.下列反应既是氧化还原反应,又是吸热反应的是( )| A. | 锌粒与稀H2SO4反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 灼热的碳与CO2反应 | D. | 葡萄糖在人体内氧化 |
分析 有电子转移的化学反应是氧化还原反应,其特征是有元素化合价升降;反应物总能量小于生成物总能量的化学反应是吸热反应,反应物总能量大于生成物总能量的化学反应是放热反应,据此分析解答.
解答 解:A.金属和酸的反应是放热反应,所以锌和稀硫酸的反应是放热反应,故A错误;
B.该反应是吸热反应,但该反应中没有元素化合价变化,不是氧化还原反应,是复分解反应,故B错误;
C.该反应中C元素化合价由0价、+4价变为+2价,所以是氧化还原反应,该该反应吸收热量,属于吸热反应,故C正确;
D.葡萄糖在人体内氧化有热量生成,属于放热反应,故D错误;
故选C.
点评 本题考查氧化还原反应、吸热反应和放热反应,明确氧化还原反应本质及其特征、反应热的有关知识即可解答,大多数分解反应都是吸热反应,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
6. 研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.
(1)用稀土等催化剂能将汽车尾气中的CO、NOx碳氢化合物转化成无毒物质,从而减少汽车尾气传染.已知:
N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式:2NO (g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ/mol.
(2)还可以用活性炭还原法处理氮氧化物,反应为C(s)+2NO(g)?N2(g)+CO2(g)H.向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应的平衡常数K=0.25(保留两位小数).
②前10min内用v(NO)表示的化学反应速率为0.0042mol/(L.min);30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是降低CO2浓度.
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2浓度之比为3:1:1,则该反应的△H<0(填“>”“=”或“<”).
(3)①用气体传感器可以检测汽车尾气中CO的含量.传感器是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.a为负极,电极反应式为CO-2e-+O2-═CO2.电池工作过程中,O2-由b极(填“a”或“b”,下同)移向a极.
②欧IV型汽车认证和生产一致性排放限值:汽油机CO1.00g/km.某测试车检测过程中,每行驶1km传感器中通过电子为0.08mol,则该车不符合(填“符合”或“不符合”)欧IV排放标准.
 研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.(1)用稀土等催化剂能将汽车尾气中的CO、NOx碳氢化合物转化成无毒物质,从而减少汽车尾气传染.已知:
N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式:2NO (g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ/mol.
(2)还可以用活性炭还原法处理氮氧化物,反应为C(s)+2NO(g)?N2(g)+CO2(g)H.向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |
②前10min内用v(NO)表示的化学反应速率为0.0042mol/(L.min);30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是降低CO2浓度.
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2浓度之比为3:1:1,则该反应的△H<0(填“>”“=”或“<”).
(3)①用气体传感器可以检测汽车尾气中CO的含量.传感器是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.a为负极,电极反应式为CO-2e-+O2-═CO2.电池工作过程中,O2-由b极(填“a”或“b”,下同)移向a极.
②欧IV型汽车认证和生产一致性排放限值:汽油机CO1.00g/km.某测试车检测过程中,每行驶1km传感器中通过电子为0.08mol,则该车不符合(填“符合”或“不符合”)欧IV排放标准.
7.X、Y、Z是三种气态物质,在一定温度下其变化符合如图.下列说法不正确的是( )
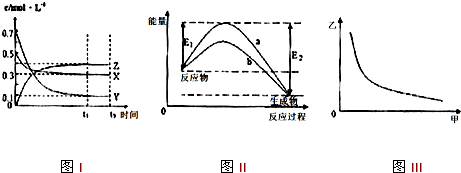

| A. | 该反应的化学方程式为X(g)+3Y(g)?2Z(g) | |
| B. | 图Ⅲ中甲表示压强,则纵坐标可表示混合气体中Z的含量或者混合气体的平均摩尔质量 | |
| C. | 若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图Ⅱ中曲线可表示有无催化剂的能量变化曲线 |
4. 偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是( )
偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是( )
 偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是( )
偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是( )| A. | BaTiO3 | B. | BaTi8O12 | C. | BaTiO4 | D. | BaTi8O4 |
11.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 等物质的量的N2和CO所含分子数均为NA | |
| B. | 2NA个HCl分子与44.8LH2和Cl2的混合气体所含的原子数目均为4NA | |
| C. | 32gCu将浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA | |
| D. | 常温常压下,1mol氦气含有核外电子数为4NA |
1.下列有关说法正确的是( )
| A. | 淀粉、油脂、蛋白质都能水解,其产物均不相同 | |
| B. | 用高锰酸钾溶液除去混在乙炔中的少量乙烯 | |
| C. | 通过银镜反应可以区分甲醛和乙醛 | |
| D. |  用图所示实验装置制取交纯净的乙酸乙酯 |
5.已知CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206kJ/mol
CH4(g)+CO2(g)═2CO(g)+2H2 (g)△H=+247kJ/mol
C-H键的键能约为413kJ/mol,O-H键的键能约为463kJ/mol,H-H键的键能约为436kJ/mol,则CO2中C=O键的键能约为( )
CH4(g)+CO2(g)═2CO(g)+2H2 (g)△H=+247kJ/mol
C-H键的键能约为413kJ/mol,O-H键的键能约为463kJ/mol,H-H键的键能约为436kJ/mol,则CO2中C=O键的键能约为( )
| A. | 797.5 kJ/mol | B. | 900.5 kJ/mol | C. | 962.5 kJ/mol | D. | 1595 kJ/mol |
6.短周期中元素a、b、c在周期表中位置如图所示,下列有关这三种元素的叙述中正确的是( )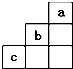

| A. | b的氢化物很稳定 | |
| B. | a是一种活泼的非金属元素 | |
| C. | c的最高价氧化物的水化物是一种弱酸 | |
| D. | b元素在化合物中的最高价为+7价 |
 ;
; ;
; (写出名称):苯甲醇
(写出名称):苯甲醇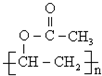 (写出单体的结构简式)CH3COOCH=CH2
(写出单体的结构简式)CH3COOCH=CH2 (写出单体的结构简式)
(写出单体的结构简式) 、HO-CH2-CH2-CH2-CH2-OH.
、HO-CH2-CH2-CH2-CH2-OH.