题目内容
6.下列有关化学用语表示正确的是( )| A. | CSO的电子式: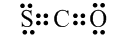 | |
| B. | 甲酸甲酯的结构简式:C2H4O2 | |
| C. | S2-离子的结构示意图: | |
| D. | 中子数为145、质子数为94的钚(Pu)原子:${\;}_{94}^{145}$Pu |
分析 A.CSO分子中含有一个碳氧双键和1个碳硫双键,各原子最外层都达到8电子稳定结构;
B.C2H4O2为分子式,结构简式需要写出其官能团;
C.硫离子的核电荷数为16,不是18;
D.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数.
解答 解:A.CSO为共价化合物,碳原子分别与氧原子和硫原子生成了两对共用电子对,其电子式为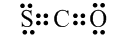 ,故A正确;
,故A正确;
B.甲酸甲酯分子中含有酯基,其正确的结构简式为HCOOCH3,故B错误;
C.硫离子的核电荷数为16,核外电子总数为18,S2-离子正确的结构示意图为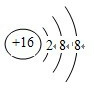 ,故C错误;
,故C错误;
D.中子数为145、质子数为94的钚(Pu)原子的质量数为239,其正确的元素符号为94239Pu,故D错误;
故选A.
点评 本题考查常见化学用语的正误判断,题目难度中等,该题为高考中的常见题型与重要的考点,试题基础性强、难易适中,主要是考查学生对常见化学用语的熟悉掌握程度,该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住.

练习册系列答案
相关题目
16.下列说法中正确的是( )
| A. | 摩尔就是物质的量 | B. | 摩尔是物质质量的单位 | ||
| C. | 氢气的摩尔质量是2g/mol | D. | 气体摩尔体积的单位为升 |
14.下列离子方程式书写正确是( )
| A. | 氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| B. | 将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2-=2Fe2++S↓ | |
| C. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| D. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
1.下列物质中,能在空气中稳定保存的是( )
| A. | NaOH固体 | B. | 稀H2SO4 | C. | Na2SO3晶体 | D. | 水玻璃 |
11. C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )
C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )
 C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )
C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )| A. | 电池放电时,溶液中钠离子向负极移动 | |
| B. | 该电池负极的电极反应为:NaMO2-xe-═Na(1-x)MO2+xNa+ | |
| C. | 消耗相同质量金属时,用锂作负极产生电子的物质的量比用钠时少 | |
| D. | 电池充电时的阳极反应式为:nC+x Na+-xe-═NaxCn |
18.要加快H2O2分解的速度,下列措施不可行的是( )
| A. | 加热或光照 | B. | 加MnO2或FeCl3 | C. | 加压 | D. | 增大H2O2的浓度 |
15. 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A. | ④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物 | |
| B. | ⑤的三种核素的化学性质不相同 | |
| C. | ⑥、⑧、⑨对应单核离子的半径依次增大 | |
| D. | ⑧、⑨两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
16.可以证明某化合物一定含有离子键的性质是( )
| A. | 熔融状态能导电 | B. | 具有较高的熔点 | C. | 可溶于水 | D. | 溶于水能导电 |
 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备