题目内容
14.下列离子方程式书写正确是( )| A. | 氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| B. | 将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2-=2Fe2++S↓ | |
| C. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| D. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
分析 A.发生氧化还原反应生成硝酸铁、NO和水;
B.反应生成FeS和S;
C.反应生成碳酸氢钙和HClO;
D.反应生成碳酸钙、碳酸钠、水.
解答 解:A.氯化亚铁溶液中加入稀硝酸的离子反应为3Fe2++4H++NO3-=3Fe3++2H2O+NO↑,故A正确;
B.将少量氯化铁溶液滴入硫化钠溶液中的离子反应为2Fe3++3S2-=2FeS+S↓,故B错误;
C.次氯酸钙溶液中通入过量二氧化碳的离子反应为ClO-+H2O+CO2=HCO3-+HClO,故C错误;
D.向碳酸氢钙溶液中加入过量的氢氧化钠溶液的离子反应为Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应方程式的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
4.实验设计和判断.为了研究过氧化氢分解速率,请回答下列问题.
(1)填写实验报告(填写空白处)
(2)过氧化氢分解的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
(3)如何改进③的实验因为浓度低很难看出不同,将两支试管同时放入盛有热水的烧杯中,或向两支试管中同时滴入1-2滴1mol/LFeCl3溶液,观察产生气泡的速率.
(4)实验结论温度、催化剂、浓度等因素都是影响过氧化氢分解速率的外界因素.
(1)填写实验报告(填写空白处)
| 目的 | 操作(文字或图示) | 实验现象 |
| ①催化剂 的影响 | ||
②温度的影响 | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | |
③浓度的影响 | 取两支试管分别加入5mL 5%H2O2溶液和5mL10%H2O2溶液 | 看不到明显的 实验现象 |
(3)如何改进③的实验因为浓度低很难看出不同,将两支试管同时放入盛有热水的烧杯中,或向两支试管中同时滴入1-2滴1mol/LFeCl3溶液,观察产生气泡的速率.
(4)实验结论温度、催化剂、浓度等因素都是影响过氧化氢分解速率的外界因素.
5.下列事实能说明氯元素非金属性比硫元素强的是( )
①HCl的溶解度比H2S大
②HCl的酸性比H2S强
③HCl的稳定性比H2S强
④HClO4的酸性比H2SO4强
⑤Cl2与铁反应生成FeCl3,而S与铁反应生成FeS.
①HCl的溶解度比H2S大
②HCl的酸性比H2S强
③HCl的稳定性比H2S强
④HClO4的酸性比H2SO4强
⑤Cl2与铁反应生成FeCl3,而S与铁反应生成FeS.
| A. | ③⑤ | B. | ③④⑤ | C. | ②③④⑤ | D. | ①②③④⑤ |
2.下已知1g氢气完全燃烧生成水蒸气时,放出热量121kJ.且氢气中1mol H-H键断裂时吸收热量为436kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氧气中1mol O=O键完全断裂时吸收热量为( )
| A. | 932kJ | B. | 496kJ | C. | 738 kJ | D. | 248 kJ |
9.元素周期表可以划分为5个区,下列有关说法正确的是( )
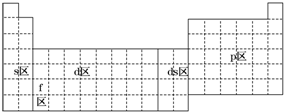

| A. | s区全部是金属元素 | |
| B. | p区全部是非金属元素 | |
| C. | d区内元素原子的价电子排布必为(n-1)d1~10ns2 | |
| D. | 除ds区外,以最后填入电子的轨道能级符号作为区的符号 |
6.下列有关化学用语表示正确的是( )
| A. | CSO的电子式: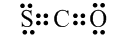 | |
| B. | 甲酸甲酯的结构简式:C2H4O2 | |
| C. | S2-离子的结构示意图: | |
| D. | 中子数为145、质子数为94的钚(Pu)原子:${\;}_{94}^{145}$Pu |
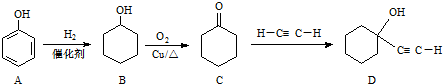
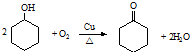 .
. ,反应类型依次是c(选填序号).
,反应类型依次是c(选填序号).