题目内容
16.下列说法中正确的是( )| A. | 摩尔就是物质的量 | B. | 摩尔是物质质量的单位 | ||
| C. | 氢气的摩尔质量是2g/mol | D. | 气体摩尔体积的单位为升 |
分析 A、物质的量的单位是摩尔;
B、摩尔是物质的量的单位;
C、一种物质的摩尔质量在数值上等于该物质的相对分子质量,单位为g/mol;
D、气体摩尔体积为1mol气体在某状态下所占据的体积.
解答 解:A、物质的量的单位是摩尔,即摩尔只是物质的量的单位,而不是物质的量,故A错误;
B、摩尔是物质的量的单位,而不是物质质量的单位,故B错误;
C、一种物质的摩尔质量在数值上等于该物质的相对分子质量,单位为g/mol,氢气的相对分子质量为2,故氢气的摩尔质量为2g/mol,故C正确;
D、气体摩尔体积为1mol气体在某状态下所占据的体积,故气体摩尔体积的单位为L/mol,故D错误.
故选C.
点评 本题考查了物质的量与摩尔之间的关系、摩尔质量的数值和单位等问题,应注意的是一种物质的摩尔质量在数值上等于该物质的相对分子质量,单位为g/mol.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
6.下列有关物质用途的叙述中,不正确的是( )
| A. | Cl2常用于自来水消毒 | |
| B. | SO2常用于漂白食品 | |
| C. | SiO2常用于制造光导纤维 | |
| D. | Na2O2可用于呼吸面具中氧气的来源 |
7.有机物阿魏酸的化学式为C10H10O4.符合下列条件的阿魏酸的同分异构体有( )
①在苯环上只有两个取代基;
②在苯环上的一氯取代物只有两种;
③1mol该同分异构体与足量NaHCO3反应生成2mol CO2.
①在苯环上只有两个取代基;
②在苯环上的一氯取代物只有两种;
③1mol该同分异构体与足量NaHCO3反应生成2mol CO2.
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
4.实验设计和判断.为了研究过氧化氢分解速率,请回答下列问题.
(1)填写实验报告(填写空白处)
(2)过氧化氢分解的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
(3)如何改进③的实验因为浓度低很难看出不同,将两支试管同时放入盛有热水的烧杯中,或向两支试管中同时滴入1-2滴1mol/LFeCl3溶液,观察产生气泡的速率.
(4)实验结论温度、催化剂、浓度等因素都是影响过氧化氢分解速率的外界因素.
(1)填写实验报告(填写空白处)
| 目的 | 操作(文字或图示) | 实验现象 |
| ①催化剂 的影响 | ||
②温度的影响 | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | |
③浓度的影响 | 取两支试管分别加入5mL 5%H2O2溶液和5mL10%H2O2溶液 | 看不到明显的 实验现象 |
(3)如何改进③的实验因为浓度低很难看出不同,将两支试管同时放入盛有热水的烧杯中,或向两支试管中同时滴入1-2滴1mol/LFeCl3溶液,观察产生气泡的速率.
(4)实验结论温度、催化剂、浓度等因素都是影响过氧化氢分解速率的外界因素.
11.将1mol 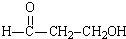 加入到足量的酸性KMnO4溶液中,充分反应后生成丙二酸,锰元素在生成物中为+2价,则消耗KMnO4的物质的量是( )
加入到足量的酸性KMnO4溶液中,充分反应后生成丙二酸,锰元素在生成物中为+2价,则消耗KMnO4的物质的量是( )
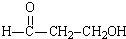 加入到足量的酸性KMnO4溶液中,充分反应后生成丙二酸,锰元素在生成物中为+2价,则消耗KMnO4的物质的量是( )
加入到足量的酸性KMnO4溶液中,充分反应后生成丙二酸,锰元素在生成物中为+2价,则消耗KMnO4的物质的量是( )| A. | 0.4mol | B. | 0.6mol | C. | 0.8mol | D. | 1.2mol |
8.下列分子中所有原子都处于同一平面上的是( )
| A. | CH4、丙烯、丙炔 | B. | 乙烯、乙炔、苯 | ||
| C. | 1,3-丁二烯、C6H5-CH3、环己烷 | D. | 丙烯、乙炔、CH3CH3 |
5.下列事实能说明氯元素非金属性比硫元素强的是( )
①HCl的溶解度比H2S大
②HCl的酸性比H2S强
③HCl的稳定性比H2S强
④HClO4的酸性比H2SO4强
⑤Cl2与铁反应生成FeCl3,而S与铁反应生成FeS.
①HCl的溶解度比H2S大
②HCl的酸性比H2S强
③HCl的稳定性比H2S强
④HClO4的酸性比H2SO4强
⑤Cl2与铁反应生成FeCl3,而S与铁反应生成FeS.
| A. | ③⑤ | B. | ③④⑤ | C. | ②③④⑤ | D. | ①②③④⑤ |
6.下列有关化学用语表示正确的是( )
| A. | CSO的电子式: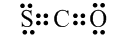 | |
| B. | 甲酸甲酯的结构简式:C2H4O2 | |
| C. | S2-离子的结构示意图: | |
| D. | 中子数为145、质子数为94的钚(Pu)原子:${\;}_{94}^{145}$Pu |
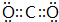 ,BA2分子中化学键属于共价键..
,BA2分子中化学键属于共价键.. .
.