题目内容
18.要加快H2O2分解的速度,下列措施不可行的是( )| A. | 加热或光照 | B. | 加MnO2或FeCl3 | C. | 加压 | D. | 增大H2O2的浓度 |
分析 根据外界条件对化学反应速率的影响解答,
A.升高温度可增大反应速率;
B.使用合适的催化剂可增大反应速率;
C.因为反应物为液态,增大压强,反应物的浓度不变;
D.增大浓度,反应速率加快;
解答 解:A.加热或光照,温度升高,可增大反应速率,故A正确;
B.加入MnO2或FeCl3作催化剂,增大反应速率,故B正确;
C.因为反应物为液态,所以增大压强,反应物的浓度不变,所以反应速率不变,故C错误;
D.增大H2O2的浓度,反应速率加快,故D正确;
故选:C;
点评 本题考查影响化学反应速率的因素,注意常见影响化学反应速率的因素温度、浓度、压强、催化剂、表面积、溶剂、光照等因素,需要注意的是压强对化学反应速率的影响,压强变化必须引起浓度变化才能引起速率变化.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
8.下列分子中所有原子都处于同一平面上的是( )
| A. | CH4、丙烯、丙炔 | B. | 乙烯、乙炔、苯 | ||
| C. | 1,3-丁二烯、C6H5-CH3、环己烷 | D. | 丙烯、乙炔、CH3CH3 |
9.元素周期表可以划分为5个区,下列有关说法正确的是( )
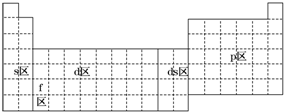

| A. | s区全部是金属元素 | |
| B. | p区全部是非金属元素 | |
| C. | d区内元素原子的价电子排布必为(n-1)d1~10ns2 | |
| D. | 除ds区外,以最后填入电子的轨道能级符号作为区的符号 |
6.下列有关化学用语表示正确的是( )
| A. | CSO的电子式: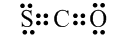 | |
| B. | 甲酸甲酯的结构简式:C2H4O2 | |
| C. | S2-离子的结构示意图: | |
| D. | 中子数为145、质子数为94的钚(Pu)原子:${\;}_{94}^{145}$Pu |
13.下列离子方程式,正确的是( )
| A. | 过氧化钠与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 澄清石灰水中通入过量二氧化碳:OH-+CO2═HCO3- | |
| C. | 往FeCl3溶液中加入Cu粉:2Fe3++3Cu=2Fe+3Cu2+ | |
| D. | CaCO3溶于稀盐酸中:CO32-+2H+═CO2↑+H2O |
3.下列说法不正确的是( )
①质子数相同的微粒一定属于同一种元素;
②同位素的性质几乎相同;
③一种元素只能有一种质量数;
④Cl2中35Cl与37Cl的原子个数之比与HCl中的35Cl与37Cl的原子个数之比相等.
①质子数相同的微粒一定属于同一种元素;
②同位素的性质几乎相同;
③一种元素只能有一种质量数;
④Cl2中35Cl与37Cl的原子个数之比与HCl中的35Cl与37Cl的原子个数之比相等.
| A. | ① | B. | ①② | C. | ①②③ | D. | ①②③④ |
10.下列各组物质发生化学反应时,由于反应物的量不同而生成不同产物的是( )
①CO2与NaOH溶液
②NaHCO3溶液与盐酸
③Na与氧气
④C与O2
⑤AlCl3溶液与氨水
⑥Na2S与FeCl3溶液.
①CO2与NaOH溶液
②NaHCO3溶液与盐酸
③Na与氧气
④C与O2
⑤AlCl3溶液与氨水
⑥Na2S与FeCl3溶液.
| A. | 除③外 | B. | 除①④⑥外 | C. | 除②③⑤外 | D. | 除②⑤外 |
7.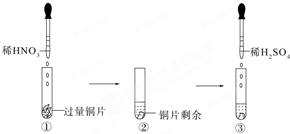 某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
 某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )| A. | 铜片溶解,因铜与稀H2SO4反应生成SO2 | |
| B. | 铜片溶解,产生无色气体,该气体为H2 | |
| C. | 无明显现象,因稀H2SO4不与铜反应 | |
| D. | 铜片溶解,产生无色气体,该气体在试管口变为红棕色 |
8.已知Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O把下列四种Na2S2O3溶液分别加入四个盛有10mL 2mol/L硫酸的锥形瓶中,并加水稀释到50mL,其中出现浑浊最快的是( )
| A. | 20℃,20mL、3mol/L的Na2S2O3溶液 | B. | 10℃,10mL、4mol/L的Na2S2O3溶液 | ||
| C. | 10℃,30mL、2mol/L的Na2S2O3溶液 | D. | 20℃,10mL、4mol/L的Na2S2O3溶液 |