题目内容
11. C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )
C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )| A. | 电池放电时,溶液中钠离子向负极移动 | |
| B. | 该电池负极的电极反应为:NaMO2-xe-═Na(1-x)MO2+xNa+ | |
| C. | 消耗相同质量金属时,用锂作负极产生电子的物质的量比用钠时少 | |
| D. | 电池充电时的阳极反应式为:nC+x Na+-xe-═NaxCn |
分析 A、原电池中,电解质中的阳离子移向正极;
B、原电池中,负极发生失电子的氧化反应;
C、由$\frac{m}{M}$×失去的电子数可知,消耗相同质量金属时,用锂做负极时,产生电子的物质的量比钠多;
D、电解池中,阳极上发生失电子的氧化反应;
解答 解:A、电池放电时,是原电池的工作原理,原电池中,电解质中的阳离子移向正极,故A错误;
B、电池放电时,负极发生失电子的氧化反应,即NaMO2-xe-═Na(1-x)MO2+xNa+,故B正确;
C、因Na的摩尔质量为23g/mol,由$\frac{m}{M}$×失去的电子数可知,消耗相同质量金属时,用锂做负极时,产生电子的物质的量比钠多,故C错误;
D、电池充电时,是电解池装置的工作原理,阳极上发生失电子的氧化反应,电极反应式为NaxCn-xe-═nC+x Na+,故D错误.
故选:B.
点评 本题考查学生原电池和电解池的工作原理知识,注意二次充电电池在工作时的电极反应情况,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
2.下已知1g氢气完全燃烧生成水蒸气时,放出热量121kJ.且氢气中1mol H-H键断裂时吸收热量为436kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氧气中1mol O=O键完全断裂时吸收热量为( )
| A. | 932kJ | B. | 496kJ | C. | 738 kJ | D. | 248 kJ |
6.下列有关化学用语表示正确的是( )
| A. | CSO的电子式: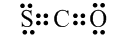 | |
| B. | 甲酸甲酯的结构简式:C2H4O2 | |
| C. | S2-离子的结构示意图: | |
| D. | 中子数为145、质子数为94的钚(Pu)原子:${\;}_{94}^{145}$Pu |
16.高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的净化处理.某工厂欲以工业废料(金属铁、铝及其氧化物)为原料、采用如下流程来制取PAFC:

下列判断无法确定的是( )

下列判断无法确定的是( )
| A. | PAFC因水解而能净水 | |
| B. | 往甲溶液中滴入KSCN溶液后呈血红色 | |
| C. | 试剂X具有氧化性 | |
| D. | 乙溶液呈酸性 |
3.下列说法不正确的是( )
①质子数相同的微粒一定属于同一种元素;
②同位素的性质几乎相同;
③一种元素只能有一种质量数;
④Cl2中35Cl与37Cl的原子个数之比与HCl中的35Cl与37Cl的原子个数之比相等.
①质子数相同的微粒一定属于同一种元素;
②同位素的性质几乎相同;
③一种元素只能有一种质量数;
④Cl2中35Cl与37Cl的原子个数之比与HCl中的35Cl与37Cl的原子个数之比相等.
| A. | ① | B. | ①② | C. | ①②③ | D. | ①②③④ |
20.用NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A. | 32克O2所含的原子数目为2NA | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.2 NA | |
| C. | 标准状况下,22.4LCO2含有NA个分子 | |
| D. | 物质的量浓度为0.5mol•L-1的MgCl2溶液中,含有Cl-个数为NA |
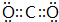 ,BA2分子中化学键属于共价键..
,BA2分子中化学键属于共价键.. .
.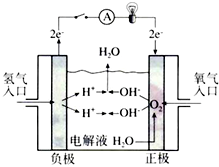 氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应.试写出:
氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应.试写出: