题目内容
17.下列实验能获得成功的是⑤(填序号)①将
 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2②
 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备
③检验淀粉已经水解,将淀粉与少量稀硫酸加热一段时间后,加入银氨溶液析出银镜
④用溴水即可检验CH2=CH-CHO中的碳碳双键
⑤将1-氯丙烷与NaOH溶液共热几分钟后,冷却、加入过量稀硝酸酸化,滴加AgNO3溶液,得白色沉淀,证明其中含有氯元素
⑥向浓苯酚中加几滴稀溴水观察到沉淀
⑦取2mL 1mol•L-1CuSO4溶液于试管中,加入10mL 2mol•L-1NaOH溶液,在所得混合物中加入40%的乙醛溶液,加热得到砖红色沉淀
⑧将乙醛滴入银氨溶液中,加热煮沸制银镜.
分析 ①将 和浓硫酸共热制备烯烃;
和浓硫酸共热制备烯烃;
② 中羧基和碳酸氢钠反应、酚羟基和碳酸氢钠不反应;
中羧基和碳酸氢钠反应、酚羟基和碳酸氢钠不反应;
③银镜反应必须在碱性条件下进行;
④溴能将醛基氧化、能和碳碳双键发生加成反应;
⑤卤代烃中卤元素检验方法是:将卤代烃和氢氧化钠的水溶液或醇溶液共热,然后向溶液中加入稀硝酸中和碱,最后加入硝酸银溶液检验卤离子;
⑥三溴苯酚能溶于苯酚;
⑦乙醛和新制的Cu(OH)2反应是在碱性环境下、加热进行,计算反应后浊液是否为碱性;
⑧银镜反应温度低于100℃.
解答 解:①将 和浓硫酸共热制备烯烃,醇和氢氧化钠的醇溶液在加热条件下不反应,故错误;
和浓硫酸共热制备烯烃,醇和氢氧化钠的醇溶液在加热条件下不反应,故错误;
② 中羧基和碳酸氢钠反应、酚羟基和碳酸氢钠不反应,所以不能实现实验目的,故错误;
中羧基和碳酸氢钠反应、酚羟基和碳酸氢钠不反应,所以不能实现实验目的,故错误;
③银镜反应必须在碱性条件下进行,该实验是在酸性条件下,所以不能实现,故错误;
④溴能将醛基氧化、能和碳碳双键发生加成反应,所以不能检验碳碳双键,应该先用银氨溶液将醛基氧化,再用溴检验碳碳双键,故错误;
⑤卤代烃中卤元素检验方法是:将卤代烃和氢氧化钠的水溶液或醇溶液共热,然后向溶液中加入稀硝酸中和碱,最后加入硝酸银溶液检验卤离子,所以该检验方法正确,故正确;
⑥向浓苯酚中加几滴稀溴水,苯酚过量,生成的三溴苯酚能溶于苯酚,所以看不到沉淀,不能实现实验目的,故错误;
⑦用新制的氢氧化铜检验,需要再碱性条件下、加热,二者物质的量相等,反应生成氢氧化铜,氢氧化钠不足量,所以加热不能生成氧化亚铜,没有红色沉淀出现,不能实现实验目的,故错误;
⑧银镜反应温度低于100℃,所以不能实现实验目的,故错误;
故选⑤.
点评 本题考查化学实验方案评价,为高频考点,涉及物质检验、官能团检验、反应条件等知识点,明确实验原理是解本题关键,知道反应条件限制,易错选项是⑥,题目难度中等.

练习册系列答案
相关题目
7.有机物阿魏酸的化学式为C10H10O4.符合下列条件的阿魏酸的同分异构体有( )
①在苯环上只有两个取代基;
②在苯环上的一氯取代物只有两种;
③1mol该同分异构体与足量NaHCO3反应生成2mol CO2.
①在苯环上只有两个取代基;
②在苯环上的一氯取代物只有两种;
③1mol该同分异构体与足量NaHCO3反应生成2mol CO2.
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
8.下列分子中所有原子都处于同一平面上的是( )
| A. | CH4、丙烯、丙炔 | B. | 乙烯、乙炔、苯 | ||
| C. | 1,3-丁二烯、C6H5-CH3、环己烷 | D. | 丙烯、乙炔、CH3CH3 |
5.下列事实能说明氯元素非金属性比硫元素强的是( )
①HCl的溶解度比H2S大
②HCl的酸性比H2S强
③HCl的稳定性比H2S强
④HClO4的酸性比H2SO4强
⑤Cl2与铁反应生成FeCl3,而S与铁反应生成FeS.
①HCl的溶解度比H2S大
②HCl的酸性比H2S强
③HCl的稳定性比H2S强
④HClO4的酸性比H2SO4强
⑤Cl2与铁反应生成FeCl3,而S与铁反应生成FeS.
| A. | ③⑤ | B. | ③④⑤ | C. | ②③④⑤ | D. | ①②③④⑤ |
12.最近医学界通过用放射性15C跟踪标记C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS),则有关15C的叙述正确的是( )
| A. | 与C60中普通碳原子的化学性质不同 | |
| B. | 与16O的中子数相同 | |
| C. | 与12C互为同位素 | |
| D. | 是足球烯的同素异形体 |
2.下已知1g氢气完全燃烧生成水蒸气时,放出热量121kJ.且氢气中1mol H-H键断裂时吸收热量为436kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氧气中1mol O=O键完全断裂时吸收热量为( )
| A. | 932kJ | B. | 496kJ | C. | 738 kJ | D. | 248 kJ |
9.元素周期表可以划分为5个区,下列有关说法正确的是( )
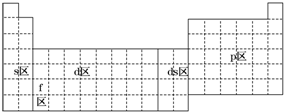

| A. | s区全部是金属元素 | |
| B. | p区全部是非金属元素 | |
| C. | d区内元素原子的价电子排布必为(n-1)d1~10ns2 | |
| D. | 除ds区外,以最后填入电子的轨道能级符号作为区的符号 |
6.下列有关化学用语表示正确的是( )
| A. | CSO的电子式: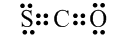 | |
| B. | 甲酸甲酯的结构简式:C2H4O2 | |
| C. | S2-离子的结构示意图: | |
| D. | 中子数为145、质子数为94的钚(Pu)原子:${\;}_{94}^{145}$Pu |
7.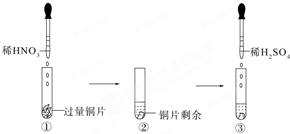 某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
 某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )| A. | 铜片溶解,因铜与稀H2SO4反应生成SO2 | |
| B. | 铜片溶解,产生无色气体,该气体为H2 | |
| C. | 无明显现象,因稀H2SO4不与铜反应 | |
| D. | 铜片溶解,产生无色气体,该气体在试管口变为红棕色 |