题目内容
15. 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A. | ④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物 | |
| B. | ⑤的三种核素的化学性质不相同 | |
| C. | ⑥、⑧、⑨对应单核离子的半径依次增大 | |
| D. | ⑧、⑨两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
分析 由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe,
A、氮的最高价氧化物对应的水化物是硝酸与氢化物氨气反应生成离子化合物硝酸铵;
B、决定化学性质应是最外层电子数,最外层电子数相同,化学性质相同;
C、电子层结构相同核电荷数越大原子半径越小,电子层越多原子半径越大;
D、氢硫酸是二元弱酸.
解答 解:由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe,
A、氮的最高价氧化物对应的水化物是硝酸与氢化物氨气反应生成离子化合物硝酸铵,故A正确;
B、决定化学性质应是最外层电子数,最外层电子数相同,化学性质相同,所以氧的三种核素化学性质相同,故B错误;
C、电子层结构相同核电荷数越大原子半径越小,电子层越多原子半径越大,故原子半径Mg>S>Cl,故C错误;
D、氢硫酸是二元弱酸,所以不全是强酸,故D错误;
故选A.
点评 本题考查元素周期表及应用,侧重元素的位置及性质的考查,注意D选项中的硫化氢是弱酸.

练习册系列答案
相关题目
5.下列事实能说明氯元素非金属性比硫元素强的是( )
①HCl的溶解度比H2S大
②HCl的酸性比H2S强
③HCl的稳定性比H2S强
④HClO4的酸性比H2SO4强
⑤Cl2与铁反应生成FeCl3,而S与铁反应生成FeS.
①HCl的溶解度比H2S大
②HCl的酸性比H2S强
③HCl的稳定性比H2S强
④HClO4的酸性比H2SO4强
⑤Cl2与铁反应生成FeCl3,而S与铁反应生成FeS.
| A. | ③⑤ | B. | ③④⑤ | C. | ②③④⑤ | D. | ①②③④⑤ |
6.下列有关化学用语表示正确的是( )
| A. | CSO的电子式: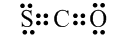 | |
| B. | 甲酸甲酯的结构简式:C2H4O2 | |
| C. | S2-离子的结构示意图: | |
| D. | 中子数为145、质子数为94的钚(Pu)原子:${\;}_{94}^{145}$Pu |
3.下列说法不正确的是( )
①质子数相同的微粒一定属于同一种元素;
②同位素的性质几乎相同;
③一种元素只能有一种质量数;
④Cl2中35Cl与37Cl的原子个数之比与HCl中的35Cl与37Cl的原子个数之比相等.
①质子数相同的微粒一定属于同一种元素;
②同位素的性质几乎相同;
③一种元素只能有一种质量数;
④Cl2中35Cl与37Cl的原子个数之比与HCl中的35Cl与37Cl的原子个数之比相等.
| A. | ① | B. | ①② | C. | ①②③ | D. | ①②③④ |
10.下列各组物质发生化学反应时,由于反应物的量不同而生成不同产物的是( )
①CO2与NaOH溶液
②NaHCO3溶液与盐酸
③Na与氧气
④C与O2
⑤AlCl3溶液与氨水
⑥Na2S与FeCl3溶液.
①CO2与NaOH溶液
②NaHCO3溶液与盐酸
③Na与氧气
④C与O2
⑤AlCl3溶液与氨水
⑥Na2S与FeCl3溶液.
| A. | 除③外 | B. | 除①④⑥外 | C. | 除②③⑤外 | D. | 除②⑤外 |
20.用NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A. | 32克O2所含的原子数目为2NA | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.2 NA | |
| C. | 标准状况下,22.4LCO2含有NA个分子 | |
| D. | 物质的量浓度为0.5mol•L-1的MgCl2溶液中,含有Cl-个数为NA |
7.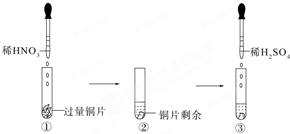 某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
 某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )| A. | 铜片溶解,因铜与稀H2SO4反应生成SO2 | |
| B. | 铜片溶解,产生无色气体,该气体为H2 | |
| C. | 无明显现象,因稀H2SO4不与铜反应 | |
| D. | 铜片溶解,产生无色气体,该气体在试管口变为红棕色 |
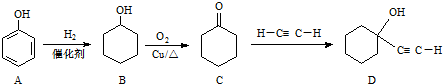
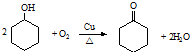 .
. ,反应类型依次是c(选填序号).
,反应类型依次是c(选填序号).