题目内容
16.可以证明某化合物一定含有离子键的性质是( )| A. | 熔融状态能导电 | B. | 具有较高的熔点 | C. | 可溶于水 | D. | 溶于水能导电 |
分析 在化合物中,只有离子化合物在熔融状态下能导电,共价化合物在熔融状态下不能导电,据此分析解答.
解答 解:A.在化合物中,离子化合物在熔融状态下含有自由移动的离子,所以熔融状态下能导电,共价化合物在熔融状态下以分子存在,所以共价化合物在熔融状态下不能导电,故A正确;
B.具有较高熔点的化合物可能是原子晶体,如二氧化硅,故B错误;
C.可溶于水的化合物可能是共价化合物,如HCl,故C错误;
D.溶于水能导电的化合物可能是共价化合物,如硝酸等,故D错误;
故选A.
点评 本题考查离子化合物和共价化合物的判断,侧重考查基本概念,明确离子化合物和共价化合物的根本区别是解本题关键,不能根据溶解性强弱、水溶液酸碱性、水溶液导电性强弱判断化合物类型,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列有关化学用语表示正确的是( )
| A. | CSO的电子式: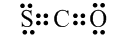 | |
| B. | 甲酸甲酯的结构简式:C2H4O2 | |
| C. | S2-离子的结构示意图: | |
| D. | 中子数为145、质子数为94的钚(Pu)原子:${\;}_{94}^{145}$Pu |
7.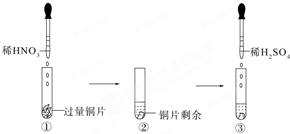 某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
 某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )| A. | 铜片溶解,因铜与稀H2SO4反应生成SO2 | |
| B. | 铜片溶解,产生无色气体,该气体为H2 | |
| C. | 无明显现象,因稀H2SO4不与铜反应 | |
| D. | 铜片溶解,产生无色气体,该气体在试管口变为红棕色 |
11.在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g)?2C(g)+D(S),可以判断达到化学平衡状态的是( )
| A. | 体系压强不变 | |
| B. | 单位时间消耗n molA,同时生成2nmolC | |
| C. | 容器内气体密度不变 | |
| D. | A、B、C、D的反应速率之比为1:1:2:1 |
8.已知Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O把下列四种Na2S2O3溶液分别加入四个盛有10mL 2mol/L硫酸的锥形瓶中,并加水稀释到50mL,其中出现浑浊最快的是( )
| A. | 20℃,20mL、3mol/L的Na2S2O3溶液 | B. | 10℃,10mL、4mol/L的Na2S2O3溶液 | ||
| C. | 10℃,30mL、2mol/L的Na2S2O3溶液 | D. | 20℃,10mL、4mol/L的Na2S2O3溶液 |
8.氨与重水(D2O)形成的碱与盐酸反应,这一反应生成的盐中阳离子的化学式是( )
| A. | NH3D+ | B. | NH2D2+ | C. | ND3H+ | D. | NH4+ |
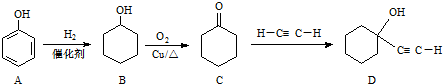
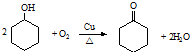 .
.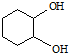 ,反应类型依次是c(选填序号).
,反应类型依次是c(选填序号).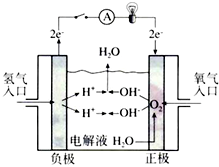 氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应.试写出:
氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应.试写出: