题目内容
1.下列关于乙酸的叙述中不正确的是( )| A. | 普通的食醋中含3%~5%(质量分数)的乙酸 | |
| B. | 醋酸是一种弱酸,其酸性比碳酸更弱 | |
| C. | 可以用醋除去烧开水的壶内壁的水垢 | |
| D. | 在一定条件下,乙酸能与乙醇发生酯化反应 |
分析 A、食醋的主要成分是乙酸,是以乙酸溶于水后形成溶液的质量分数来衡量的;
B、醋酸是一种弱酸,但是酸性强于碳酸;
C、水垢的主要成分为碳酸钙,依据强酸制取弱酸原理解答即可;
D、乙醇与乙酸能发生酯化反应.
解答 A、食醋的主要成分是乙酸,普通的食醋中含3%~5%(质量分数)的乙酸,故A正确;
B、醋酸是一种弱酸,但是酸性强于碳酸,故B错误;
C、水垢的主要成分为碳酸钙,醋酸的酸性强与碳酸,故乙酸能与碳酸钙反应生成二氧化碳气体,起到除去水垢的作用,故C正确;
D、乙醇与乙酸能发生酯化反应,故D正确,故选B.
点评 本题主要考查的是乙酸在生活中的存在以及常见用途,还涉及酯化反应的定义等,难度不大.

练习册系列答案
相关题目
9.最新科技报道,美国夏威夷联合天文中心的科学家发现了新型氢粒子,这种氢粒子是由3个氢原子核(只含质子)和2个电子构成的.对于这种粒子,下列说法中正确的是( )
| A. | 是氢的一种新的同素异形体 | B. | 3g该新型氢粒子含电子2NA | ||
| C. | 是氢的一种新的同位素 | D. | 它的组成可用H3表示 |
6.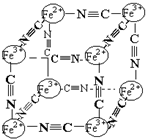 分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
 分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )| A. | 该晶体是原子晶体 | |
| B. | M的离子位于上述立方体的面心,呈+2价 | |
| C. | M的离子位于上述立方体的体心,呈+1价,且M+空缺率(体心中没有M+的占总体心的百分比)为50% | |
| D. | 晶体的化学式可表示为MFe2(CN)3,且M为+1价 |
10.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.下列说法正确的是( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的化学能 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 醋酸逐渐凝固的过程要吸收能量 |
11.下列溶液中有关物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO32-)+c(HCO3-)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO32-)>c(HCO3-) | |
| D. | 0.2 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |

 .
.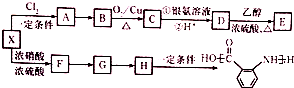
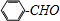 ;
; ;②
;②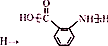 :
: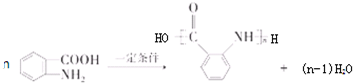 ;
;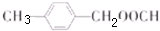 ;
;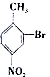 合成
合成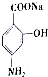 的转化流程图(写出反应物和反应条件).
的转化流程图(写出反应物和反应条件).