题目内容
20.在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好反应,则a+b>14(填“>”、“<”或“=”);该温度下醋酸的电离常数为K=$\frac{1{0}^{-2b}}{1{0}^{a-14}-1{0}^{-b}}$(用含a、b的式子表示)分析 pH=a的氢氧化钠溶液中c(NaOH)=c(OH-)=10a-14mol/L,醋酸部分电离,则pH=b的醋酸溶液中c(醋酸)>10-bmol/L,酸碱恰好中和,则酸的物质的量与碱的物质的量相等,据此分析;醋酸的电离常数K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,c(醋酸)=c(NaOH),氢离子浓度已知,则可以计算出K.
解答 解:pH=a的氢氧化钠溶液中c(NaOH)=c(OH-)=10a-14mol/L,醋酸部分电离,则pH=b的醋酸溶液中c(醋酸)>10-bmol/L,酸碱恰好中和,则酸的物质的量与碱的物质的量相等,则c(NaOH)=c(OH-)=10a-14mol/L=c(醋酸)>10-bmol/L,所以10a-14>10-b,则a+b>14;c(醋酸)=c(NaOH)=10a-14mol/L,c(H+)=c(CH3COO-)=10-bmol/L,则醋酸的电离常数K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{1{0}^{-b}•1{0}^{-b}}{1{0}^{a-14}-1{0}^{-b}}$=$\frac{1{0}^{-2b}}{1{0}^{a-14}-1{0}^{-b}}$;
故答案为:>;$\frac{1{0}^{-2b}}{1{0}^{a-14}-1{0}^{-b}}$.
点评 本题考查了酸碱混合溶液的有关计算,难度不大,侧重于考查学生对知识的综合应用能力和数据处理能力.

练习册系列答案
相关题目
10.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.下列说法正确的是( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的化学能 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 醋酸逐渐凝固的过程要吸收能量 |
11.下列溶液中有关物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO32-)+c(HCO3-)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO32-)>c(HCO3-) | |
| D. | 0.2 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
15.我国京津冀地区部分城市常出现雾霾,其主要成分为细颗粒、SO2和NxOy、重金属离子及芳香烃等,对环境危害极大,对其治理越来越受到重视.下列说法正确的是( )
| A. | 重金属离子Ag+、Cu2+、K+均可导致蛋白质变性 | |
| B. | S02和NxOy都属于非金属氧化物,也都是酸性氧化物 | |
| C. | 部分颗粒分散在空气中可能会形成丁达尔现象 | |
| D. | 苯和苯的衍生物都是芳香烃 |
5.常温下,1L pH=3的H2SO4溶液与下列溶液混合,其说法正确的是( )
| A. | 与等体积pH=11的氨水混合后所得溶液pH小于7 | |
| B. | 与pH=3的CH3COOH溶液混合后所得溶液pH小于3 | |
| C. | 与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7 | |
| D. | 与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10 |
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 11.2 LO2和O3组成的混合气体含有原子数为NA | |
| B. | 常温常压下,1.7 g NH3含有的电子数目为 NA | |
| C. | 0.1mol/LNa2SO4溶液中含有Na+的个数为0.2NA | |
| D. | 标准状况下,22.4 L NO2与足量的H2O充分反应后转移电子数为 NA |
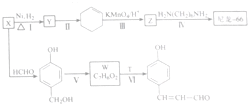

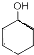 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,反应类型为消去反应
+H2O,反应类型为消去反应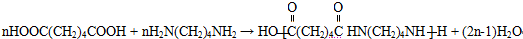 ,反应类型为缩聚反应
,反应类型为缩聚反应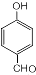 ,T的分子式为C2H4O
,T的分子式为C2H4O .
.