题目内容
3.铁的许多化合物在水的净化处理工艺中有着广泛的应用.Ⅰ.化合物甲是一种暗紫色有光泽的粉末,经组成分析,仅含有Fe、K、O三种元素.水溶性实验表明,化合物甲具有良好的水溶性,且溶解后所得溶液中会逐渐析出红褐色沉淀乙,同时放出一种具有 氧化性的无色单质气体丙.实验测得,当生成标准状况下2.24L气体丙时,会有14.3g沉淀乙析出.
(1)气体丙的电子式为
 ;化合物甲与H2O反应的离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
;化合物甲与H2O反应的离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;(2)化合物甲被称为“绿色高效水处理剂”,用文字简要表述其处理水的原理是用高铁酸钾处理水时,+6价铁表现出强氧化性,能杀菌消毒,其还原产物为铁离子,水解生成氢氧化铁胶体,能吸附水中的悬浮杂质;
Ⅱ.氯化铁也是常见的水处理剂.下图为制备氯化铁及进一步氧化制备上述化合物甲的工艺流程.

(1)吸收剂X的化学式为FeCl2;氧化剂Y的化学式为NaClO.
(2)碱性条件下反应①的离子方程式为3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O.
(3)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品.该反应的化学方程式为
2KOH+Na2FeO4→甲+2NaOH,该反应发生的原因最可能是A.
A.甲溶解度较Na2FeO4小,析出晶体,促进反应进行
B.甲比Na2FeO4难电离,是更弱的电解质
C.甲是配合物,而Na2FeO4是复盐
(4)结合上述信息,在提纯甲时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用B(填序号).
A.H2O B.稀KOH溶液、异丙醇C.NH4Cl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
Ⅲ.可用滴定分析法测定K2FeO4的纯度,有关反应离子方程式为:
①FeO42-?+CrO2-+2H2O→CrO42-?+Fe(OH)3↓+OH-?
②2CrO42-?+2H+→Cr2O72-?+H2O
③Cr2O7 2-+6Fe2++14H+→2Cr3++6Fe3++7H2O
现称取1.980g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液定容于250mL容量瓶中.每次取25.00mL加入稀硫酸酸化,用0.1000mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93mL.则上述样品中高铁酸钾的质量分数为63.1%.(答案用小数表示,保留3位小数)
分析 I.化合物甲仅含有Fe、K、O三种元素,甲具有良好的水溶性,且溶解后所得溶液中会逐渐析出红褐色沉淀乙,同时放出一种具有氧化性的无色单质气体丙,根据元素守恒可知丙为O2,则红褐色沉淀为氢氧化铁,所以n(O2)=0.1mol,n(氢氧化铁)=$\frac{14.3g}{107g/mol}$,设甲Fe元素的化合价为+x价,则(x-3)×$\frac{14.3g}{107g/mol}$=4×0.1mol,则x=6,即甲Fe元素的化合价为+6价,所以甲为K2FeO4;
(1)氧气中含有2个共用电子对,原子均满足8电子结构;K2FeO4与水反应生成氢氧化铁、氢氧化钾和氧气;
(2)根据+6价Fe的强氧化性和氢氧化铁胶体的吸附性分析;
II.氯气与铁反应生成三氯化铁,冷却得到三氯化铁固体,尾气中含有氯气,用氯化亚铁溶液吸收得到氯化铁溶液,把氯化铁固体溶于吸收液得到浓氯化铁溶液,氯气与氢氧化钠溶液反应生成次氯酸钠溶液,次氯酸钠具有强氧化性,与氯化铁溶液反应生成Na2FeO4,然后向该溶液中加饱和的KOH溶液,析出固体K2FeO4;
(1)根据流程分析判断;
(2)碱性条件下NaClO把铁离子氧化为铁酸根离子,反应①的离子方程式为3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
(3)2KOH+Na2FeO4 =K2FeO4+2NaOH,反应能发生的原因K2FeO4的溶解度比Na2FeO4小而溶液中K+、FeO42-的浓度比较大;
(4)洗涤时要尽可能的减少K2FeO4的损失,用KOH可以减少K2FeO4的溶解,用异丙醇可以洗去表面的水,而且异丙醇易挥发,低温烘干可以除去残留的异丙醇;
III.根据反应①②③可知:2FeO42-~~~~6Fe2+,根据关系式计算出K2FeO4的物质的量和质量,再计算质量分数.
解答 解:I.化合物甲仅含有Fe、K、O三种元素,甲具有良好的水溶性,且溶解后所得溶液中会逐渐析出红褐色沉淀乙,同时放出一种具有氧化性的无色单质气体丙,根据元素守恒可知丙为O2,则红褐色沉淀为氢氧化铁,所以n(O2)=0.1mol,n(氢氧化铁)=$\frac{14.3g}{107g/mol}$,设甲Fe元素的化合价为+x价,则(x-3)×$\frac{14.3g}{107g/mol}$=4×0.1mol,则x=6,即甲Fe元素的化合价为+6价,所以甲为K2FeO4;
(1)氧气中含有2个共用电子对,原子均满足8电子结构,其电子式为 ;K2FeO4与水反应生成氢氧化铁、氢氧化钾和氧气,反应的离子方程式为:4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
;K2FeO4与水反应生成氢氧化铁、氢氧化钾和氧气,反应的离子方程式为:4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
故答案为: ;4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
;4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
(2)铁酸钾中Fe元素为+6价具有强氧化性,在水中能杀菌消毒,其还原产物为铁离子,能水解生成氢氧化铁胶体,胶体具有吸附性,能吸附水中的悬浮杂质,从而起到净水的作用;
故答案为:用高铁酸钾处理水时,+6价铁表现出强氧化性,能杀菌消毒,其还原产物为铁离子,水解生成氢氧化铁胶体,能吸附水中的悬浮杂质;
II.氯气与铁反应生成三氯化铁,冷却得到三氯化铁固体,尾气中含有氯气,用氯化亚铁溶液吸收得到氯化铁溶液,把氯化铁固体溶于吸收液得到浓氯化铁溶液,氯气与氢氧化钠溶液反应生成次氯酸钠溶液,次氯酸钠具有强氧化性,与氯化铁溶液反应生成Na2FeO4,然后向该溶液中加饱和的KOH溶液,析出固体K2FeO4;
(1)根据流程分析可知吸收剂X的化学式为FeCl2;氧化剂Y的化学式为NaClO,故答案为:FeCl2;NaClO;
(2)碱性条件下根据反应物和产物可知,反应①的离子方程式为3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O,故答案为:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
(3)过程②的反应的化学方程式为2KOH+Na2FeO4 =K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因K2FeO4的溶解度比Na2FeO4小而溶液中K+、FeO42-的浓度比较大,故答案为:A;
(4)洗涤时要尽可能的减少K2FeO4的损失,用KOH可以减少K2FeO4的溶解,用异丙醇可以洗去表面的水,而且异丙醇易挥发,低温烘干可以除去残留的异丙醇,所以洗涤操作时最好选用稀KOH溶液、异丙醇,故答案为:B;
III.根据反应①②③可知:2FeO42-~~~~6Fe2+,
1mol 3mol
n 0.1000mol/L×0.01893L
则n=6.31×10-4mol,
所以样品中高铁酸钾的质量分数为$\frac{6.31×1{0}^{-4}mol×\frac{250}{25}×198g/mol}{1.98g}$×100%=63.1%;
故答案为:63.1%.
点评 本题考查了物质的制备流程的理解应用、实验基本操作、物质性质的分析应用、有关方程式的计算、氧化还原反应等,题目涉及的知识点较多,侧重于考查学生的实验能力和对基础知识的综合应用能力,熟练掌握基础是关键,题目难度中等.

| A. | 氨气: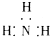 | B. | 四氯化碳: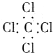 | C. | 氮气: | D. | 二氧化碳: |
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4)/mol•L-1 | v(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/S | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
(1)实验4和5表明固体反应物的表面积对反应速率有影响.
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有1、3、4(填实验序号).
(3)其实验6和其实验7表明温度对反应速率有影响.
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:可能是硫酸过量,等质量的金属完全反应,放出的热量相等,所以使等体积溶液的温度升高值相近.
 如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | SO3 | H2SO4 | S |
| A. | A | B. | B | C. | C | D. | D |
| A. | 20Ar | B. | 16O | C. | 18O | D. | 18O2- |
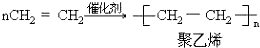 ;反应类型加聚反应.
;反应类型加聚反应.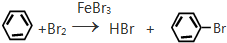 ;反应类型取代反应.
;反应类型取代反应.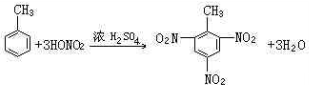 ;反应类型硝化反应(取代反应).
;反应类型硝化反应(取代反应).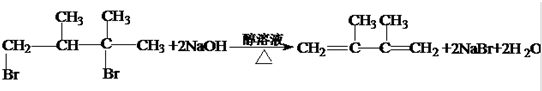 ;反应类型消去反应.
;反应类型消去反应.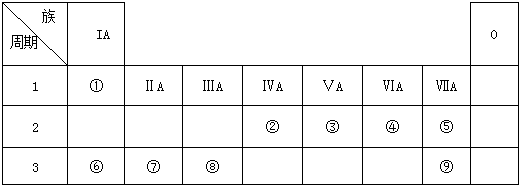
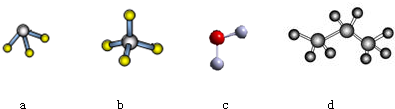
 .
.
 元素①和⑨形成的化合物甲中含有共价键键,请用电子式表示物质甲的形成过程是
元素①和⑨形成的化合物甲中含有共价键键,请用电子式表示物质甲的形成过程是 .
.


 +H2O;
+H2O; 和物质HC≡C-CH3也可以发生类似反应②的反应,写出该反应的化学方程式:
和物质HC≡C-CH3也可以发生类似反应②的反应,写出该反应的化学方程式: +HC≡C-CH3→
+HC≡C-CH3→ +HI.
+HI.