��Ŀ����
13��д�����л�ѧ��Ӧ����ʽ����1������ϩ�Ʊ�����ϩ��
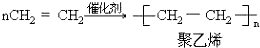 ����Ӧ���ͼӾ۷�Ӧ��
����Ӧ���ͼӾ۷�Ӧ����2��2-�ȱ�����NaOH��ˮ��Һ���ȣ�CH3CHClCH3+NaOH��CH3CHOHCH3+NaCl����Ӧ����ˮ�ⷴӦ��ȡ����Ӧ����
��3��ʵ�������屽��
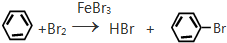 ����Ӧ����ȡ����Ӧ��
����Ӧ����ȡ����Ӧ����4���ױ���Ũ�����Ũ������Һ���������������ױ���
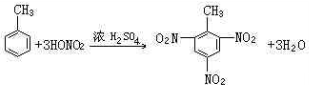 ����Ӧ����������Ӧ��ȡ����Ӧ����
����Ӧ����������Ӧ��ȡ����Ӧ������5��1��3-����-2��3-����������NaOH�Ĵ���Һ���ȣ�
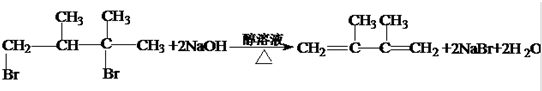 ����Ӧ������ȥ��Ӧ��
����Ӧ������ȥ��Ӧ��
���� ��1����ϩ�����ӳɾۺϷ�Ӧ�����Ʊ�����ϩ��
��2��±������ǿ���ˮ��Һ�з���ȡ����Ӧ���ɴ���
��3���������ڴ����������·���ȡ����Ӧ�����屽��
��4���ױ���Ũ�����Ũ������Һ���������������ױ���ˮ��
��5��1��3-����-2��3-����������NaOH�Ĵ���Һ���Ȼᷢ����ȥ��Ӧ����ϩ�����ݴ���д��
��� �⣺��1����ϩ�����ӳɾۺϷ�Ӧ�����Ʊ�����ϩ����ӦΪ��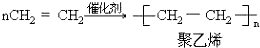 �����ڼӾ۷�Ӧ���ʴ�Ϊ��
�����ڼӾ۷�Ӧ���ʴ�Ϊ��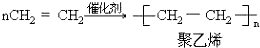 ���Ӿ۷�Ӧ��
���Ӿ۷�Ӧ��
��2��2-�ȱ�����NaOH��ˮ��Һ��������2-��������CH3CHClCH3+NaOH��CH3CHCH3+������ˮ�ⷴӦ��ȡ����Ӧ�����ʴ�Ϊ��
��3���������ڴ����������·���ȡ����Ӧ�����屽����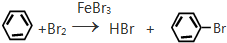 ��ȡ����Ӧ���ʴ�Ϊ��
��ȡ����Ӧ���ʴ�Ϊ��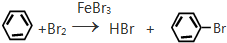 ��ȡ����Ӧ��
��ȡ����Ӧ��
��4���ױ���Ũ�����Ũ������Һ���������������ױ���ˮ����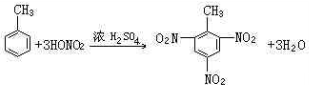 ������������Ӧ���ʴ�Ϊ��
������������Ӧ���ʴ�Ϊ��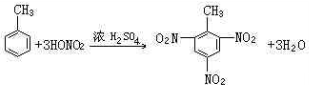 ��������Ӧ��ȡ����Ӧ����
��������Ӧ��ȡ����Ӧ����
��5��1��3-����-2��3-����������NaOH�Ĵ���Һ���Ȼᷢ����ȥ��Ӧ����ϩ���������ķ�ӦΪ�� ��������ȥ��Ӧ��
��������ȥ��Ӧ��
�ʴ�Ϊ�� ����ȥ��Ӧ��
����ȥ��Ӧ��
���� ���⿼�����л����ʵ�����Ӧ�ã������˻�ѧ����ʽ����д�������л�������ŵ���������д��ѧ����ʽ�Ĺؼ�����Ŀ�ѶȲ���

 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�
| A�� | ���ֶ�Ʒ�ж����б����������ڷ����� | |
| B�� | ҡͷ�辭��ȥ���ӳɷ�Ӧ���Ƶñ��� | |
| C�� | 1mol��������ˮ��Ӧ�������4mol Br2 | |
| D�� | �Ȱ�ͪ�����л�������̼ԭ�ӿ��ܹ�ƽ�� |
| A�� | NH3D+ | B�� | NH2D2+ | C�� | ND3H+ | D�� | NH4+ |
| A�� | 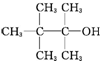 | B�� | CH3��CH2��5CH2OH | C�� |  | D�� | 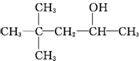 |
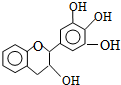 ���豶���������к��в��ӣ���������Ŀǰ�в����˹��ϳɵĴ���Ȼ����ܡ���Ч�ܵĿ������������ɻ�������������ûʳ�Ӷ����أ�EGC���Ľṹ��ͼ��ʾ������EGC��������������ȷ���ǣ�������
���豶���������к��в��ӣ���������Ŀǰ�в����˹��ϳɵĴ���Ȼ����ܡ���Ч�ܵĿ������������ɻ�������������ûʳ�Ӷ����أ�EGC���Ľṹ��ͼ��ʾ������EGC��������������ȷ���ǣ�������| A�� | ����ʽΪC15H12O5 | |
| B�� | ���������е�ԭ�ӹ��� | |
| C�� | 1molEGC��4molNaOHǡ����ȫ��Ӧ | |
| D�� | ����������Ӧ��ȡ����Ӧ���ѷ����ӳɷ�Ӧ |
| A�� | HCHO | B�� | CH3OH | C�� | HCOOH | D�� | CH3COOCH3 |
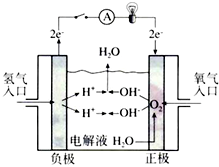 ����ȼ�ϵ�������ں���ɻ�����30%KOH��ҺΪ�������Һ�����ֵ����ʹ��ʱ�ĵ缫��Ӧ����д����
����ȼ�ϵ�������ں���ɻ�����30%KOH��ҺΪ�������Һ�����ֵ����ʹ��ʱ�ĵ缫��Ӧ����д����
 �����������H2O��Ӧ�����ӷ���ʽΪ4FeO42-+10H2O=4Fe��OH��3��+3O2��+8OH-��
�����������H2O��Ӧ�����ӷ���ʽΪ4FeO42-+10H2O=4Fe��OH��3��+3O2��+8OH-��