题目内容
15. 如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | SO3 | H2SO4 | S |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Al(OH)3不能一步转化为Al;
B.每步转化均可一步实现;
C.SiO2不能一步转化为H2SiO3,H2SiO3不能一步转化为Si;
D.S一步转化生成SO2,不能得到SO3;H2SO4不能一步转化为S.
解答 解:A.Al(OH)3不能一步转化为Al,不符合图中转化,故A不选;
B.HNO3$\stackrel{Cu}{→}$NO$?_{H_{2}O}^{O_{2}}$NO2,NO2$\stackrel{H_{2}O}{→}$HNO3,每步转化均可一步实现,符合图中转化,故B选;
C.SiO2不能一步转化为H2SiO3,H2SiO3不能一步转化为Si,不符合图中转化,故C不选;
D.S一步转化生成SO2,不能得到SO3;H2SO4不能一步转化为S,不符合图中转化,故D不选.
故选B.
点评 本题考查物质的性质及转化,为高频考点,综合考查元素化合物性质,注意转化中均一步完成为解答的关键,把握发生的化学反应即可解答,题目难度不大.

练习册系列答案
相关题目
5.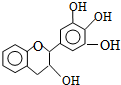 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 分子式为C15H12O5 | |
| B. | 分子中所有的原子共面 | |
| C. | 1molEGC与4molNaOH恰好完全反应 | |
| D. | 易发生氧化反应和取代反应,难发生加成反应 |
6.下列说法错误的是( )
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 双原子单质分子中的共价键一定是非极性键 |
10.邻甲基苯甲酸( )有多种同分异构体,其中属于酯类,且分子结构中含有甲基和苯环的异构体有( )
)有多种同分异构体,其中属于酯类,且分子结构中含有甲基和苯环的异构体有( )
 )有多种同分异构体,其中属于酯类,且分子结构中含有甲基和苯环的异构体有( )
)有多种同分异构体,其中属于酯类,且分子结构中含有甲基和苯环的异构体有( )| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
7.下列元素的单质的氧化性最强的是( )
| A. | F | B. | Cl | C. | Br | D. | I |
4.用铁片与稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是( )
| A. | 给该反应体系适当加热 | B. | 向反应体系中加水稀释 | ||
| C. | 向反应体系中加入适量浓盐酸 | D. | 将铁片换成铁粉 |
5.下列物质中,只含有非极性键的是( )
| A. | NaOH | B. | Na2O2 | C. | P4 | D. | H2O2 |
 ;化合物甲与H2O反应的离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
;化合物甲与H2O反应的离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;