题目内容
12.某科研小组合成纳米人的其中一部分,具体反应式如下所示(各反应均在一定条件下进行,方程式中条件省略).
请回答下列问题:
(1)A→B的反应类型是取代反应;
(2)已知物质D可以发生银镜反应,D的相对分子质量为345,分子中有一个氧原子、一个溴原子,含碳66.1%,其余为氢,
计算物质D的分子式为C19H21OBr;
(3)写出D→E的化学反应方程式:
 +H2O;
+H2O;(4)下列关于物质E的说法不正确的是ad;(双选)
a.能与银氨溶液反应
b.1mol E最多能和7mol氢气反应
c.不能与硝酸银溶液反应生成黄色沉淀
d.核磁共振氢谱中有3个吸收峰
(5)物质
 和物质HC≡C-CH3也可以发生类似反应②的反应,写出该反应的化学方程式:
和物质HC≡C-CH3也可以发生类似反应②的反应,写出该反应的化学方程式: +HC≡C-CH3→
+HC≡C-CH3→ +HI.
+HI.
分析 (1)比较A和B的结构简式可知A→B的反应类型;
(2)D的相对分子质量为345,分子中有一个氧原子、一个溴原子,含碳66.1%,则碳原子数为$\frac{345×66.1%}{12}$=19,其余为氢,则氢原子数为$\frac{345-16-80-19×12}{1}$=21,据此写分子式;
(3)已知物质D可以发生银镜反应,说明D中不醛基,根据D的分子式结合E的结构简式可知D为 ,据此写化学方程式;
,据此写化学方程式;
(4)根据E的结构简式可知,E中有两个碳碳参键,一个苯环,还有醚键和溴原子等,据此判断;
(5)反应②的反应为取代反应,是物质 中的碘原子被取代,据此写化学方程式;
中的碘原子被取代,据此写化学方程式;
解答 解:(1)比较A和B的结构简式可知A→B的反应类型为取代反应,
故答案为:取代反应;
(2)D的相对分子质量为345,分子中有一个氧原子、一个溴原子,含碳66.1%,则碳原子数为$\frac{345×66.1%}{12}$=19,其余为氢,则氢原子数为$\frac{345-16-80-19×12}{1}$=21,所以D的分子式为C19H21OBr,
故答案为:C19H21OBr;
(3)已知物质D可以发生银镜反应,说明D中不醛基,根据D的分子式结合E的结构简式可知D为 ,所以D→E的化学反应方程式为
,所以D→E的化学反应方程式为 +H2O,
+H2O,
故答案为: +H2O;
+H2O;
(4)a.E中没有醛基,所以不能与银氨溶液反应,故a错误;
b.根据E的结构简式可知,E中有两个碳碳参键,一个苯环,所以1mol E最多能和7mol氢气反应,故b正确;
c.碳链上的溴原子不能与硝酸银溶液反应生成黄色沉淀,故c正确;
d.根据E的结构简式可知,E的核磁共振氢谱中有5个吸收峰,故d错误;
故答案为:a d;
(5)反应②的反应为取代反应,是物质 中的碘原子被取代,化学方程式为
中的碘原子被取代,化学方程式为 +HC≡C-CH3→
+HC≡C-CH3→ +HI,
+HI,
故答案为: +HC≡C-CH3→
+HC≡C-CH3→ +HI;
+HI;
点评 本题考查了有机物的推断,明确有机物的官能团及其性质是解本题关键,注意物质转化过程中官能团的变化,题目难度中等.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案| A. | HCHO | B. | CH3OH | C. | HCOOH | D. | CH3COOCH3 |
| A. | F | B. | Cl | C. | Br | D. | I |
①甘油 ②油脂 ③纤维素 ④淀粉 ⑤有机玻璃 ⑥蛋白质 ⑦蔗糖 ⑧天然橡胶 ⑨2,4,6-三硝基甲苯(TNT) ⑩涤纶.
| A. | ①④⑥⑦ | B. | ①②⑦⑨ | C. | ③⑤⑥⑩ | D. | ②③⑦⑧ |
| A. | 给该反应体系适当加热 | B. | 向反应体系中加水稀释 | ||
| C. | 向反应体系中加入适量浓盐酸 | D. | 将铁片换成铁粉 |
 ;化合物甲与H2O反应的离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
;化合物甲与H2O反应的离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
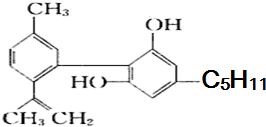 大麻酚及它的衍生物都属麻醉药品,并且毒性较强.吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中,而且由于大麻中焦油含量高,其致癌率也较高.大麻酚分子结构为:
大麻酚及它的衍生物都属麻醉药品,并且毒性较强.吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中,而且由于大麻中焦油含量高,其致癌率也较高.大麻酚分子结构为: ,它与足量的溴水反应最多消耗Br23mol.
,它与足量的溴水反应最多消耗Br23mol.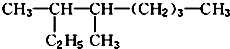 的名称是3,4-二甲基辛烷
的名称是3,4-二甲基辛烷 .
.