题目内容
14.下列电子式正确的是( )| A. | 氨气: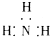 | B. | 四氯化碳: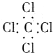 | C. | 氮气: | D. | 二氧化碳: |
分析 A、氨气中存在三对N-H键,氮原子中存在一对孤电子对;
B、四氯化碳中Cl原子最外层8个电子;
C、氮气中存在三对共价键,氮原子最外层电子数为8;
D、二氧化碳中存在2对C-O共价键,据此解答即可.
解答 解:A、氨气分子的电子式没写出氮原子上的孤对电子,正确应为: ,故A错误.
,故A错误.
B、四氯化碳中Cl原子周围有8个电子,没有标出来,正确应为: ,故B错误.
,故B错误.
C、氮气分子的电子式为: ,故C正确.
,故C正确.
D、二氧化碳中C与O之间各有2对电子,其电子式为: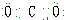 ,故D错误.
,故D错误.
故选C.
点评 判断型选择题的做法是:根据正确的书写方式判断选项是否正确.共价化合物和非金属多原子分子的电子式书写,不仅要写共用电子对还要写各原子最外层上的孤对电子.

练习册系列答案
相关题目
5.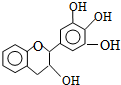 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 分子式为C15H12O5 | |
| B. | 分子中所有的原子共面 | |
| C. | 1molEGC与4molNaOH恰好完全反应 | |
| D. | 易发生氧化反应和取代反应,难发生加成反应 |
2.下列有机物在核磁共振氢谱上只有一组峰的是( )
| A. | HCHO | B. | CH3OH | C. | HCOOH | D. | CH3COOCH3 |
9.一定量的乙醇在氧气不足情况下燃烧,得到CO、CO2和H2O的总质量为27.6g,其中水的质量为10.8g,则CO的质量为( )
| A. | 1.4g | B. | 2.2g | C. | 2.8g | D. | 4.4g |
19.可逆反应:在密闭容器反应2NO2?2NO+O2,达到平衡状态的标志是( )
(1)单位时间内生成2moL NO2的同时生成2moL NO
(2)单位时间内生成2moL NO的同时,生成1moL O2
(3)用反应物和生成物的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态.
(1)单位时间内生成2moL NO2的同时生成2moL NO
(2)单位时间内生成2moL NO的同时,生成1moL O2
(3)用反应物和生成物的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态.
| A. | (1)(4)(5) | B. | (2)(3)(5) | C. | (1)(3)(4) | D. | (1)(2)(3)(4)(5) |
6.下列说法错误的是( )
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 双原子单质分子中的共价键一定是非极性键 |
4.用铁片与稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是( )
| A. | 给该反应体系适当加热 | B. | 向反应体系中加水稀释 | ||
| C. | 向反应体系中加入适量浓盐酸 | D. | 将铁片换成铁粉 |

 ;化合物甲与H2O反应的离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
;化合物甲与H2O反应的离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;