题目内容
【题目】乙酰丙酮铜是金属有机化合物中一种重要的化合物,广泛应用于化工、石油、制药、电子、材料、机械等领域。实验室制备原理如下:
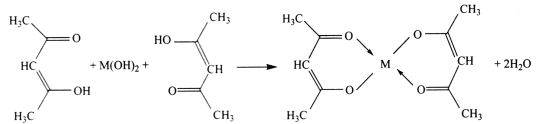
实验步骤:
(1)制取氢氧化铜(II)
分别称取4.000g(0.1mol)氢氧化钠、8.000g(0.05mol)无水硫酸铜于250mL、100mL烧杯中,加入适量的蒸馏水使其溶解,然后将硫酸铜溶液倒入氢氧化钠溶液中,摇匀,使反应完全,再将沉淀进行抽滤。
(2)制备乙酰丙酮铜(II)
称取0.1960g(2mmol)新制的氢氧化铜于100mL仪器a中,在氮气保护下加入少量的四氢呋喃,并进行搅拌,约五分钟之后,加入0.4000g(4mmol)乙酰丙酮,补充四氢呋喃约30mL,在50℃下加热回流约2h,然后冷却至室温,转移到锥形瓶中,用薄膜封口,放置4~5天,得到蓝色针状晶体。
已知:
I.氢氧化铜(II)分解温度为60℃。
II.四氢呋喃易挥发,沸点66℃,储存时应隔绝空气,否则易被氧化成过氧化物。
III.乙酰丙酮铜(II)是一种蓝色针状晶体,难溶于水,微溶于乙醇,易溶于苯、氯仿、四氯化碳。66.66kPa压力下,78℃升华。
回答下列问题:
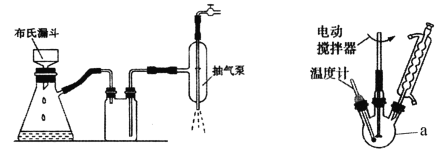
(1)制取氢氧化铜(II)时采用抽滤的方式进行,已知抽滤装置如图所示,抽滤与常规过滤相比其优点是____________________。
(2)制备乙酰丙酮铜(II)时采用氮气保护的目的________________,加入四氢呋喃的作用是__________________。
(3)加热回流简易装置如图(加热部分省略)所示,仪器a的名称是_______________,加热回流时采用球形冷凝管而不选用直形冷凝管的原因是________________。加热方式宜采用_______________。在50℃下加热回流的原因除防止四氢呋喃挥发外,还有可能的原因是_____________(用化学方程式表示)。
(4)若要纯化乙酰丙酮铜晶体,可以采用的实验方法是___________。若纯化后蓝色针状晶体的质量为0.3630g(乙酰丙酮铜的相对分子质量为262),则产率为________%。
【答案】加快过滤速率 排尽系统中的空气,防止四氢呋喃被氧化 作为溶剂使氢氧化铜和乙酰丙酮混合充分,加快反应速率,提高产率 三颈烧瓶 与冷却水接触面积更大,冷却效率更高 水浴加热 Cu(OH)2![]() CuO+H2O 升华 69.27
CuO+H2O 升华 69.27
【解析】
用氢氧化钠与硫酸铜反应制备氢氧化铜,新制氢氧化铜与乙酰丙酮形成配合物,其中各物质的分解或挥发温度均为70℃左右,故利用水浴加热控制反应温度在50℃,据此回答问题。
(1)制取氢氧化铜(II)时采用抽滤的方式进行,利用抽滤瓶内低压环境,使滤液趁热快速通过,即抽滤与常规过滤相比其优点是加快过滤速率。
(2) 四氢呋喃储存时隔绝空气,否则易被氧化成过氧化物,即制备乙酰丙酮铜(II)时采用氮气保护的目的排尽系统中的空气,防止四氢呋喃被氧化,加入四氢呋喃的作用是作为溶剂使氢氧化铜和乙酰丙酮混合充分,加快反应速率,提高产率。
(3)加热回流简易装置如图所示,仪器a的名称是三颈烧瓶,加热回流时采用球形冷凝管而不选用直形冷凝管的原因是与冷却水接触面积更大,冷却效率更高。加热温度维持在50℃,加热方式宜采用水浴加热。在50℃下加热回流的原因除防止四氢呋喃挥发外,还有可能的原因是氢氧化铜受热分解,Cu(OH)2![]() CuO+H2O。
CuO+H2O。
(4) 66.66kPa压力下,78℃升华,若要纯化乙酰丙酮铜晶体,可以采用的实验方法是升华。若纯化后蓝色针状晶体的质量为0.3630g(乙酰丙酮铜的相对分子质量为262),根据反应式可知,氢氧化铜反应了2mmol,生成产物应为2mmol,则产率为![]() 。
。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案【题目】在3个体积均为2.0L的恒容密闭容器中,反应CO2(g)+C(s)![]() 2CO(g) H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )
2CO(g) H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )
容器 | 温度/K | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
Ⅰ | 977 | 0.28 | 0.56 | 0 | 0.4 |
Ⅱ | 977 | 0.56 | 0.56 | 0 | x |
Ⅲ | 1250 | 0 | 0 | 0.56 | y |
A.达到平衡时,向容器Ⅰ中增加C(s)的量,平衡正向移动
B.x=0.8,y>0.4
C.达到平衡时,容器Ⅲ中的CO的转化率小于![]()
D.若起始时向容器Ⅱ中充入0.1molCO2、0.2molCO和足量的C(s),则反应将向正反应方向进行