题目内容
【题目】已知P4单质的结构如下,P4在 KOH 溶液中的变化是:P4 + 3KOH + 3H2O = 3KH2PO2 + PH3 ↑,下列说法正确的是( )
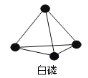
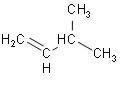
A.产物 PH3分子中所有的原子可能共平面
B.31gP4含有 1.5NA个 P P 键
C.相关元素的电负性大小顺序:P > O > H > K
D.P4中 P 原子为 sp2杂化
【答案】B
【解析】
A. PH3分子的空间结构为三角锥形,所有的原子不可能共平面,A错误;
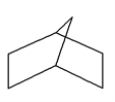
B. P4的空间构型为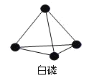 ,31gP4的物质的量为0.25mol,含有 1.5NA个 P P 键,B正确;
,31gP4的物质的量为0.25mol,含有 1.5NA个 P P 键,B正确;
C. 同一周期,从左到右电负性增大,同一主族,从上到下电负性减小,所以电负性O>P,C错误;
D. P4分子中P原子含有的价层电子对数是4,其中含有一对孤对电子,所以P原子的杂化形式为sp3杂化,D错误;
故答案为:B。

 阅读快车系列答案
阅读快车系列答案【题目】硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4。回答下列问题:
(1)写出基态Zn原子的价电子排布式__,基态S原子核外未成对电子数为__。
(2)ZnSO4中三种元素的电负性由大到小的顺序为__,SO42-的立体构型为__,其中S的杂化轨道类型为__。
(3)硫酸锌溶于氨水可生成[Zn(NH3)4]SO4溶液,[Zn(NH3)4]SO4溶液中不存在的微粒间作用力有__。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
(4)根据下列锌卤化物的熔点和溶解性,分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因__。
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
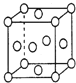
(5)钾晶体晶胞结构如图所示,距离最近的两个钾原子距离为acm,阿伏加德罗常数为NA。
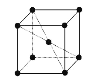
①钾原子核外运动状态不同的电子数是___。
②钾晶体的密度是___。