题目内容
2.一种气态烷烃和一种气态烯烃的混合物共10g,平均相对分子质量为25.使混合气通过足量溴水,溴水增重8.4g.通过计算回答:①混合物的物质的量为0.4mol
②混合物中的各组分的分子式为CH4、C2H4,体积之比为CH4与C2H4比为1:3.
分析 ①根据混合气体的平均相对分子质量为25及n=$\frac{m}{M}$计算出该混合烃的总物质的量;
②根据平均相对分子质量可以确定混合气体中一定有甲烷,该混合气通过Br2水时,Br2水增重8.4g,8.4g为烯烃的质量,所以甲烷的质量为1.6g,物质的量为:$\frac{1.6g}{16g/mol}$=0.1mol,从而得出该烯烃的物质的量,结合烯烃的质量和物质的量来确定烯烃的摩尔质量,再根据烯烃组成通式确定烯烃的分子式;设出该烷烃和烯烃的体积,根据平均分子质量确定其体积比.
解答 解:①混合气体的平均相对分子质量为25,总质量为10g,则该混合烃的物质的量为:$\frac{10g}{25g/mol}$=0.4mol,
故答案为:0.4mol;
②烯烃的最小相对分子质量为28,烷烃中只有甲烷的相对分子质量小于25,故混合气体中一定有甲烷,
该混合气通过Br2水时,Br2水增重的8.4g为烯烃的质量,则甲烷的质量为:10g-8.4g=1.6g,甲烷的物质的量为:$\frac{1.6g}{16g/mol}$=0.1mol,
烯烃的物质的量为:0.4mol-0.1mol=0.3mol,M(烯烃)=$\frac{8.4g}{0.3mol}$=28g•mol-1,设烯烃的组成为CnH2n,则14n=28,所以n=2,
故该烯烃为乙烯,所以混合物为CH4、C2H4;
设混合烃中含有甲烷体积为x、乙烯体积为y,
则:$\frac{16x+28y}{x+y}$=25,整理可得:x:y=1:3,
故答案为:CH4、C2H4;CH4与C2H4比为1:3.
点评 本题考查了有机物分子式的确定,题目难度中等,明确乙烯的化学性质为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用,试题培养了学生的分析能力及化学计算能力.

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案| A. | C2H6和C4H10 | B. | C3H8和C5H10 | C. | C6H6和C6H12 | D. | CH4和C2H2 |
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | T的最高价氧化物对应水化物溶液一定显碱性 |
| A. | 升高温度 | B. | 不断补充氮气 | ||
| C. | 增大压强 | D. | 及时将NH3从密闭容器中转移走 |
| A. | CO2 | B. | CHCl3 | C. | 甲烷 | D. | CH2Cl2 |
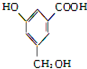 分别与NaHCO3、Na、NaOH反应消耗掉的三者的物质的量之比为( )
分别与NaHCO3、Na、NaOH反应消耗掉的三者的物质的量之比为( )| A. | 1:1:1 | B. | 1:3:2 | C. | 2:3:1 | D. | 1:2:3 |
| A. | 第三周期ⅥA族 | B. | 第二周期ⅥA族 | C. | 第三周期ⅣA族 | D. | 第二周期ⅣA族 |
| A. | H2b+n-8ROb | B. | HnROb | C. | H8-nROb | D. | H2b-n-8ROb |
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |