题目内容
13.如图所示,甲池的总反应式为N2H4+O2=N2+2H2O,.下列说法正确的是( )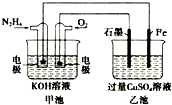
| A. | 甲池中负极上的电极反应式为N2H4-4e-=N2+4H+ | |
| B. | 乙池中石墨电极上发生的反应为4OH--4e-=2H2O+O2↑ | |
| C. | 甲池溶液pH增大,乙池溶液pH减小 | |
| D. | 甲池中每消耗0.1mol N2H4乙池电极上则会析出6.4g固体 |
分析 A、甲池中为原电池反应,N2H4失电子生成氮气;
B、乙池中为电解反应,石墨电极与正极相连为阳极,氢氧根在阳极失电子发生氧化反应;
C、根据电池的总反应判断PH的变化;
D、根据电路中每个电极得失电子守恒计算.
解答 解:A、甲池中为原电池反应,负极N2H4-4e-+4OH-=N2+4H2O,故A错误;
B、乙池中为电解反应,石墨电极与正极相连为阳极,氢氧根在阳极失电子发生氧化反应,反应式为4OH--4e-=2H2O+O2↑,故B正确;
C、甲池中因反应生成了水会使溶液的pH值减小,乙池中因反应生成了酸也会使溶液的pH值减小,故C错误;
D、甲池中每消耗0.1mol N2H4,则根据负极N2H4-4e-+4OH-=N2+4H2O,转移0.4mol电子,所以乙池电极上则会析出$\frac{0.4mol}{2}$×64g/mol=12.8g铜,故D错误.
故选B.
点评 本题考查了原电池、电解池工作的基本原理,以及原电池电极反应式的书写,题目难度中等,注意把握原电池和电解池中电极方程式的书写方法.

练习册系列答案
相关题目
1.下列有关电解质溶液中微粒的关系不正确的是( )
| A. | 将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 | |
| B. | 25℃时,pH=3的氯化铵溶液中:c(OH-)=1.0×10-11mol•L-1 | |
| C. | 25℃时,pH=4的氯化铵溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
4.若要产生一定量的氯气,下列物质分别与足量浓盐酸反应,消耗的物质的量最少的是( )
| A. | KMnO4 | B. | KClO3 | C. | MnO2 | D. | Ca(ClO)2 |
1.下列与处理方法对应的反应方程式不正确的是( )
| A. | 工业上用水吸收NO2生产硝酸:3NO2+H2O=2HNO3+NO | |
| B. | 用氨水除去工业原料氯化铵中的氯化铁杂质:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 用熟石灰处理泄漏的液氯:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O | |
| D. | 用明矾除去水中的悬浮颗粒物:Al3++3H2O?Al(OH)3(胶体)+3H+ |
8.在测定中和热的实验中,下列说法正确的是( )
| A. | 使用环形玻璃搅拌棒是为了加快反应速率,使其充分反应,减小实验误差 | |
| B. | 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触 | |
| C. | 为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸) | |
| D. | 在测定中和热实验中需要使用的仪器有量筒、烧杯、胶头滴管、温度计等 |
18.与下列装置相关的说法中不正确的是( )
| A. | 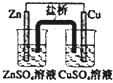 如装置中,盐桥中的K+移向CuSO4溶液 | |
| B. | 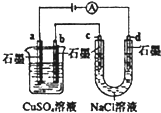 如图装置中b极析出6.4g固体时,d极产生2.24LH2 | |
| C. | 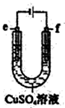 用如图装置精炼铜时,f极为粗铜 | |
| D. | 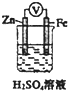 如图装置中电子沿导线由Zn流向Fe,Fe极上有大量气泡生成 |
5.下列各组的排列顺序中,正确的是( )
| A. | 原子半径 Na<Mg<Al | B. | 酸性 H2SiO3<H2CO3<H2SO4 | ||
| C. | 稳定性 HF<HCl<HBr | D. | 碱性 NaOH<Mg(OH)2<Al(OH)3 |
