题目内容
2.CO2和CH4是两种主要的温室气体,以CH4和CO2为原料制造更高价值的化学产品是目前缓解温室效应的研究方向.回答下列问题:(1)由CO2制取C的太阳能工艺如图1所示.
①“热分解系统”发生的反应为2Fe3O4$\frac{\underline{\;>2300K\;}}{\;}$6FeO+O2↑,则每分解lmolFe3O4转移电子的物质的量为2mol.
②“重整系统”发生反应的化学方程式为6FeO+CO2$\frac{\underline{\;700K\;}}{\;}$C+2Fe3O4.
(2)一定条件下,CO2和CH4反应可生产合成气(CO、H2的混合气体),其可用于合成多种液体燃料.
已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H2=-802.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.0kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.7kJ•mol-1
(3)CO2催化加氢可合成低碳烯烃,起始时在0.1MPa下,以n(H2):n(CO2)=3:1的投料比例将反应物放入反应器中,发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H,保持压强不变,不同温度下,平衡时的四种气态物质的量如图2所示:
①曲线Ⅱ表示的物质为H2O(填化学式),该反应的△H<(填“>”或“<”)0.
②A、B两点对应的反应的反应速率v(A)、v(B)的大小关系为v(A)<v(B).B、C两点对应温度下反应的平衡常数大小关系为K(B)<(填“>”“<”或“=”)K(C)
③为提高CO2平衡转化率,除改变温度外,还可以采取的措施是增大压强.(列举一种)

分析 (1)①lmolFe3O4含有2mol三价铁和1mol二价铁;
②FeO还原二氧化碳得到四氧化三铁和C;
(2)已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H2=-802.3kJ•mol-1①
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.0kJ•mol-1②
2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1③
由盖斯定律:①+2×②-2×③得到CO2(g)+CH4(g)?2CO(g)+2H2(g),据此计算;
(3)①IV表示氢气,则III表示二氧化碳,另外两条表示C2H4和水,根据C2H4与水的计量数判断;升高温度,氢气的物质的量增大,平衡逆移;
②温度越高反应速率越快;B点温度大于C点,升高温度平衡逆移;
③提高CO2平衡转化率,则平衡正移,根据影响平衡的因素分析.
解答 解:(1)①lmolFe3O4含有2mol三价铁和1mol二价铁,反应为Fe全部为+2价,则lmolFe3O4得到2mol电子,故答案为:2mol;
②FeO还原二氧化碳得到四氧化三铁和C,则其反应方程式为:6FeO+CO2$\frac{\underline{\;700K\;}}{\;}$C+2Fe3O4,故答案为:6FeO+CO2$\frac{\underline{\;700K\;}}{\;}$C+2Fe3O4;
(2)已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H2=-802.3kJ•mol-1①
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.0kJ•mol-1②
2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1③
由盖斯定律:①+2×②-2×③得到CO2(g)+CH4(g)?2CO(g)+2H2(g),△H=(-802.3)+2×(-41.0)-2×(-566.0)=+247.7kJ/mol;
故答案为:+247.7;
(3)①IV表示氢气,则III表示二氧化碳,另外两条表示C2H4和水,已知方程中C2H4的计量数比水的计量数小,则水的变化较快,所以II变化快,表示水;升高温度,氢气的物质的量增大,平衡逆移,说明正反应为放热反应,即△H<0;
故答案为:H2O;<;
②温度越高反应速率越快,B点的温度大于A点的温度,所以v(A)<v(B);B点温度大于C点,升高温度平衡逆移,则温度越高,K越小,所以B点的K小于C点;
故答案为:v(A)<v(B);<;
③提高CO2平衡转化率,则平衡正移,已知该反应正方向为体积减小的反应,所以增大压强平衡正移,能提高CO2平衡转化率,故答案为:提高CO2平衡转化率.
点评 本题考查了氧化还原反应、盖斯定律的应用、影响速率和平衡的因素、平衡常数等,题目难度中等,侧重于考查学生对基础知识的综合应用能力和读图能力.

| A. | 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物 | |
| B. | 两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同分异构体 | |
| C. | 相对分子质量相同的几种化合物,互称为同分异构体 | |
| D. | 组成元素的质量分数相同,且相对分子质量也相同的不同化合物,一定互为同分异构体 |
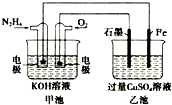
| A. | 甲池中负极上的电极反应式为N2H4-4e-=N2+4H+ | |
| B. | 乙池中石墨电极上发生的反应为4OH--4e-=2H2O+O2↑ | |
| C. | 甲池溶液pH增大,乙池溶液pH减小 | |
| D. | 甲池中每消耗0.1mol N2H4乙池电极上则会析出6.4g固体 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑨ | ||||
| 3 | ① | ② | ③ | ⑦ | ⑧ |
 .
.(2)九种元素中非金属性最强的是F(填元素符号),元素⑧的氢化物的电子式为
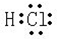 ,
,(3)除⑨外,原子半径最大的是Na(填元素符号).在①、②、③三种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式).电子式为
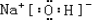 ,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).(4)⑥⑦⑧三种元素的气态氢化物的稳定性由强到弱的顺序是HF>HCl>H2S.(用相应的氢化物的化学式作答)
(5)元素④对应的氢化物的化学式是NH3,电子式为
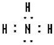 ,其水溶液的pH>7(填“<”或“>”).
,其水溶液的pH>7(填“<”或“>”).(6)⑦⑧两种元素对应的最高价含氧酸的酸性由强到弱的顺序是HClO4>H2SO4.(用相应的最高价氧化物对应水化物的化学式作答)
(7)①的阳离子与⑥的阴离子的电子层结构与⑨元素的原子的电子层结构相同,这两种离子的半径由大到小的顺序是F->Na+(用相应离子符号作答).
(8)这些元素的最高价氧化物对应水化物呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.

(a、b、c均大于零)下列说法正确的是( )
| A. | H2、I2和HI都是共价化合物 | |
| B. | 断开2 mol HI分子中的化学键所需能量约为(c+b+2a) kJ | |
| C. | 相同条件下,1 mol H2(g)和1mol I2(g)总能量小于2 mol HI (g)的总能量 | |
| D. | 向密闭容器中加入1 mol H2(g)和1 mol I2(g),充分反应后放出的热量为2a kJ |
| A. | 甲苯和环己烯都能使酸性高锰酸钾溶液褪色 | |
| B. | 用银氨溶液可以鉴别乙醛和葡萄糖溶液 | |
| C. | 甲醛和乙二醇都可作为合成高分子化合物的单体 | |
| D. | 丙烷和2-甲基丙烷的一氯代物均为两种 |
| A. | 苯在常温下可与溴水发生取代反应 | |
| B. | 糖类、油脂和蛋白质都能发生水解反应 | |
| C. | 乙醇和乙酸都能与金属钠反应 | |
| D. | 葡萄糖能发生氧化反应和银镜反应 |
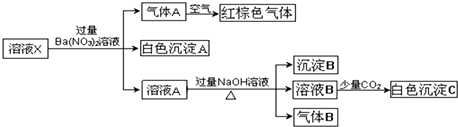
| A. | 原溶液中可能含有NO3-和Al3+ | |
| B. | 白色沉淀C可能是Al(OH)3 | |
| C. | 原溶液中一定存在NH4+、Fe2+、SO42-、Cl- | |
| D. | 沉淀B可能是Fe(OH)2和Fe(OH)3的混合物 |
| A. | 碘有智力元素之称,所以应该大量服用补碘药片 | |
| B. | 汽车尾气中的氮氧化物是汽油不完全燃烧产生的 | |
| C. | 二氧化硫可用于食品防腐,但不能用于食品漂白 | |
| D. | “辽宁舰”上使用的特种钢缆属于新型无机非金属材料 |