题目内容
1.下列有关电解质溶液中微粒的关系不正确的是( )| A. | 将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 | |
| B. | 25℃时,pH=3的氯化铵溶液中:c(OH-)=1.0×10-11mol•L-1 | |
| C. | 25℃时,pH=4的氯化铵溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
分析 A.Kw只受温度的影响;
B.根据pH=-lg[c(H+)]结合Kw=c(H+)×c(OH-)计算;
C.氯化铵溶液显示酸性,则c(H+)>c(OH-),结合电荷守恒可知c(Cl-)>c(NH4+);
D.向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中,溶质为硫酸钠和硫酸铵,溶液呈酸性.
解答 解:A.Kw只受温度的影响,温度不变,则Kw不变,故A错误;
B.pH=3的氯化铵溶液中c(H+)=1.0×10-3mol•L-1,则c(OH-)=1.0×10-11mol•L-1,故B正确;
C.pH=4的氯化铵溶液中,c(H+)>c(OH-),由电荷守恒可知应存在c(Cl-)>c(NH4+),溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故C正确;
D.向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中,溶质为硫酸钠和硫酸铵,因铵根离子水解而导致溶液呈酸性,则c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故D正确;
故选A.
点评 本题考查离子浓度大小比较,为高考常见题型,题目难度中等,注意把握盐类水解的影响因素,结合电荷守恒、物料守恒解答,易错点为D,注意物质的物质的量之间的关系.

练习册系列答案
相关题目
11.将18g铜和铁的混合物投入200mL稀硝酸中,充分反应后得到标准状况下2.24L NO,剩余9.6g金属;继续加入200mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24L NO.若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法中正确的是( )
| A. | 原混合物中铜和铁各0.15 mol | |
| B. | 稀硝酸的物质的量浓度为1 mol•L-1 | |
| C. | 第一次剩余9.6 g金属为铜和铁 | |
| D. | 再加入上述200 mL稀硝酸,还会得到标准状况下2.24 L NO |
12.下列有关化学用语表达不正确的是( )
| A. | CO2分子的结构式:O=C=O | B. | 氮气的电子式: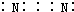 | ||
| C. | 钙离子的电子式:Ca2+ | D. | Na的原子结构示意图: |
9.某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol?L-1、2.00mol?L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为20℃、35℃,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验 编号 | T/℃ | 大理石 规格 | HNO3浓度 (mol?L-1) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响; |
| ② | ||||
| ③ | 粗颗粒 | 2.00 | ||
| ④ | 25 |
13.A,B,C,D四种短周期主族元素的原子序数依次减小,D在短周期主族元素中原子半径最大,C原子最外层电子数与电子层数相等,B元素的主要化合价:最高正价+最低负价=4,下列说法正确的是( )
| A. | C的氧化物是碱性氧化物 | |
| B. | D与A能形成原子个数比为1:1型的离子化合物 | |
| C. | 最高价氧化物对应水化物的酸性:B>A | |
| D. | 工业上电解由A,C两种元素组成的化合物制备C单质 |
12.下列有关同系物、同分异构体的说法正确的是( )
| A. | 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物 | |
| B. | 两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同分异构体 | |
| C. | 相对分子质量相同的几种化合物,互称为同分异构体 | |
| D. | 组成元素的质量分数相同,且相对分子质量也相同的不同化合物,一定互为同分异构体 |
13.如图所示,甲池的总反应式为N2H4+O2=N2+2H2O,.下列说法正确的是( )
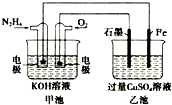

| A. | 甲池中负极上的电极反应式为N2H4-4e-=N2+4H+ | |
| B. | 乙池中石墨电极上发生的反应为4OH--4e-=2H2O+O2↑ | |
| C. | 甲池溶液pH增大,乙池溶液pH减小 | |
| D. | 甲池中每消耗0.1mol N2H4乙池电极上则会析出6.4g固体 |
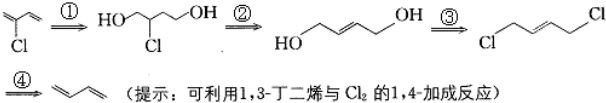
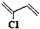 )是制备氯丁橡胶的原料,它只比1,3-丁二烯(
)是制备氯丁橡胶的原料,它只比1,3-丁二烯( )多了一个氯原子,但由于双键上的氢原子很难发生取代反应,不能通过1,3-丁二烯直接与氯气反应制得,2-氯-1,3-丁二烯的逆合成分析为:
)多了一个氯原子,但由于双键上的氢原子很难发生取代反应,不能通过1,3-丁二烯直接与氯气反应制得,2-氯-1,3-丁二烯的逆合成分析为: