题目内容
4.若要产生一定量的氯气,下列物质分别与足量浓盐酸反应,消耗的物质的量最少的是( )| A. | KMnO4 | B. | KClO3 | C. | MnO2 | D. | Ca(ClO)2 |
分析 根据物质和浓盐酸反应的特点,等物质的量的各个物质得到电子数越多,则生成氯气越多,则生成等量的氯气消耗的物质的量最少,据此回答判断.
解答 解:设物质的量都是1mol,
KMnO4中的Mn从+7降为+2价,
KClO3中Cl从+5降为0价,
MnO2中的Mn从+4价降为+2价,
Ca(ClO)2中的Cl从+1价降为0价,
转移电子分别是:5mol、5mol、2mol、2mol,并且B中,氯酸钾和盐酸反应中,氧化产物与还原产物均为氯气,所以产生的氯气最多,则生成等量的氯气,消耗的氯酸钾的物质的量最少.
故选B.
点评 本题考查氧化还原反应的计算,把握反应中元素的化合价变化计算转移电子为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.下列有关化学用语表达不正确的是( )
| A. | CO2分子的结构式:O=C=O | B. | 氮气的电子式: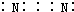 | ||
| C. | 钙离子的电子式:Ca2+ | D. | Na的原子结构示意图: |
13.A,B,C,D四种短周期主族元素的原子序数依次减小,D在短周期主族元素中原子半径最大,C原子最外层电子数与电子层数相等,B元素的主要化合价:最高正价+最低负价=4,下列说法正确的是( )
| A. | C的氧化物是碱性氧化物 | |
| B. | D与A能形成原子个数比为1:1型的离子化合物 | |
| C. | 最高价氧化物对应水化物的酸性:B>A | |
| D. | 工业上电解由A,C两种元素组成的化合物制备C单质 |
12.下列有关同系物、同分异构体的说法正确的是( )
| A. | 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物 | |
| B. | 两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同分异构体 | |
| C. | 相对分子质量相同的几种化合物,互称为同分异构体 | |
| D. | 组成元素的质量分数相同,且相对分子质量也相同的不同化合物,一定互为同分异构体 |
19.下列叙述不正确的是( )
| A. | 1.68g铁粉发生吸氧腐蚀时,理论上最多能吸收氧气504mL(标准状况) | |
| B. | 镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 | |
| C. | 为保护海轮的船壳,常在船壳外面镶上锌块 | |
| D. | 化学电源的能量来源于氧化还原反应所释放的化学能 |
16.下列解释实验现象的方程式不正确的是( )
| A. | 向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH4+=2NH3•H2O+Mg2+ | |
| B. | SO2通入澄清石灰水中,产生白色沉淀:SO2+Ca2++2OH-=CaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 长期过量服用阿司匹林出现水杨酸(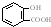 )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: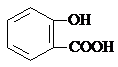 +HCO3-→ +HCO3-→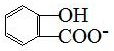 +CO2↑+H2O +CO2↑+H2O |
13.如图所示,甲池的总反应式为N2H4+O2=N2+2H2O,.下列说法正确的是( )
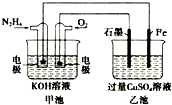

| A. | 甲池中负极上的电极反应式为N2H4-4e-=N2+4H+ | |
| B. | 乙池中石墨电极上发生的反应为4OH--4e-=2H2O+O2↑ | |
| C. | 甲池溶液pH增大,乙池溶液pH减小 | |
| D. | 甲池中每消耗0.1mol N2H4乙池电极上则会析出6.4g固体 |
14.下列关于有机化合物的说法正确的是( )
| A. | 苯在常温下可与溴水发生取代反应 | |
| B. | 糖类、油脂和蛋白质都能发生水解反应 | |
| C. | 乙醇和乙酸都能与金属钠反应 | |
| D. | 葡萄糖能发生氧化反应和银镜反应 |
 将0.40mol N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H.在Tl℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
将0.40mol N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H.在Tl℃和T2℃时,测得NO2的物质的量随时间变化如图所示: