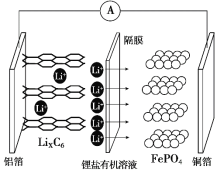
题目内容
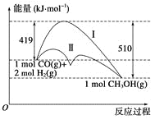
【题目】科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。下列说法错误的是
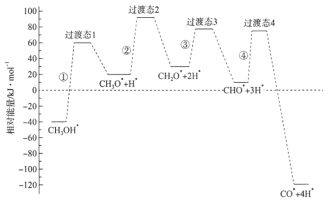
A.②中包含C—H键的断裂过程
B.该历程中能垒(反应活化能)最小的是③
C.该历程中制约反应速率的方程式为CH3O*+3H* CO*+4H*
D.由此历程可知:![]() △H<0
△H<0
【答案】CD
【解析】
A.②中由CH3O*→CH2O*,则包含C—H键的断裂过程,故A正确;
B.活化能为反应物的总能量与过渡态能量之差,从图中可以看出,③发生的反应活化能最小,故B正确;
C.活化能越大,反应速率越慢,反应速率慢的反应制约反应速率,由图示可知①的活化能最大,发生的反应为CH3OH*→CH3O*+H*,故C错误;
D.图示可知整个历程![]() △H>0,故D错误;
△H>0,故D错误;
故答案为CD。

练习册系列答案
相关题目