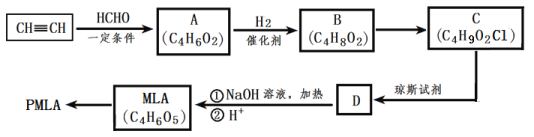
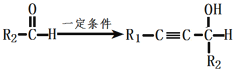
题目内容
【题目】将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,使合金全部溶解。向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液体积的关系如图曲线所示。则盐酸的物质的量浓度为( )

A.1mol/LB.8mol/LC.10mol/LD.12mol/L
【答案】B
【解析】
从图中横坐标可以看出,开始加入NaOH溶液时,没有产生沉淀,此段发生反应:HCl+NaOH═NaCl+H2O,当NaOH继续加入,发生反应MgCl2+2NaOH═Mg(OH)2↓+2NaCl、AlCl3+3NaOH═Al(OH)3↓+3NaCl,沉淀为氢氧化镁和氢氧化铝,当氢氧化钠溶液为160mL时,沉淀达最大值,此时溶液中溶质只有NaCl,根据钠原子守恒n(NaCl)=n(NaOH)=0.16L×5mol/L=0.8mol,根据氯原子守恒有n(HCl)=n(NaCl)=0.8mol,所以该盐酸的物质的量浓度为:c(HCl)=![]() 故选B。
故选B。

 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案【题目】有U、V、W、X四种前三周期元素,原子序数依次增大,其相关信息如下表:
元素编号 | 相关信息 |
U | 所处的周期数、族序数分别与其原子序数相等 |
V | 外层电子数是最内层电子数的两倍 |
W | 单质中有三对共用电子对 |
X | 是地壳中含量最多的元素 |
请回答下列问题:
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子的空间构型为________。
(2)写出W单质的结构式 ___________,其化学键为________性共价键:W最简单气态氢化物的电子式为___________,分子的空间构型是___________,其化学键为___________性共价键。
(3)X在周期表中的位置是_______,该主族元素的气态氢化物中,沸点最低的是__________(填化学式)
(4)乙和丙分别是V和X的某种氢化物,这两种氢化物分子中含有有18个电子。乙和丙的化学式分别是________、________。
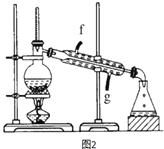
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制环己烯。
已知:![]()
密度( | 熔点℃ | 沸点℃ | 溶解性 | |
环己醇 | 0.096 | 25 | 161 | 能溶于水 |
环己烯 | 0.081 | -103 | 83 | 难溶于水 |
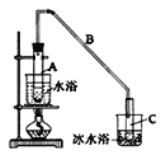
制备粗品:
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
(1)A中瓷片的作用是______,导管B除了导气外还具有的作用是______;
(2)试管C置于冰水浴中的目的是__________________________。
制备精品:
(3)环己烯粗品中含有环己醇和少量酸性杂质等。加入少量食盐水,振荡、静置、分层,环己烯在_______层(填“上”或“下”),分液后用_________(填入编号)洗涤;
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
(4)再将环己烯按图2装置蒸馏,冷却水从_______(填f或g)口进入,蒸馏时要加入生石灰,目的是______________。收集产品时,温度应控制在_____左右。
(5)以下区分环己烯精品与粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
若用上述装置制备乙酸乙酯,回答下列问题。
(6)用分液漏斗提纯试管C中的乙酸乙酯,在操作时要注意振荡洗涤后,静置分液前必须放气,具体操作方法是__________(填编号)
a.将仪器正放在架子或铁圈上打开上部塞子
b.将仪器正放在架子或铁圈上打开活塞
c.用手心抵住仪器上部塞子倒置后打开活塞
d.将该仪器平放在实验台上打开活塞
(7)所制得的酯应从该分液漏斗的__________(填编号)
a.下部流出 b.上口倒出 c.都可以
(8)在提纯乙酸乙酯时,为什么要使用饱和碳酸钠溶液,而不用NaOH溶液洗涤?
______________________________________。