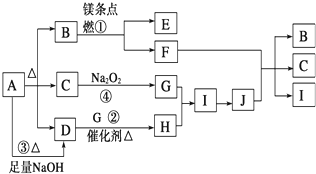
题目内容
2.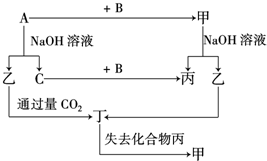 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图所示的转换关系,已知C为密度最小的气体,甲是电解质.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图所示的转换关系,已知C为密度最小的气体,甲是电解质.根据图示转化关系回答:
(1)写出下列物质的化学式:BO2,乙NaAlO2.
(2)组成单质A的元素在周期表中的位置是第三周期第ⅢA族,丙的电子式是
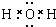 .
.(3)写出下列变化的方程式:
①A与NaOH溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②乙与过量CO2反应的离子方程式AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-.
(4)A、B、丙三种物质的熔点由高到低的顺序为Al>H2O>O2(用化学式表示).
分析 C为密度最小的气体,则C是H2,金属A和氢氧化钠溶液反应生成乙和氢气,中学阶段学习的能和氢氧化钠溶液反应生成氢气的金属只有Al,所以A是Al,乙是NaAlO2,铝和单质B反应生成甲,甲中含有铝元素,甲是电解质,能和氢氧化钠溶液,则甲是Al2O3,B是O2,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,则丙是H2O,偏铝酸钠和二氧化碳反应生成氢氧化铝和碳酸氢钠,丁失去水生成氧化铝,则丁是Al(OH)3,结合物质的性质分析解答.
解答 解:C为密度最小的气体,则C是H2,金属A和氢氧化钠溶液反应生成乙和氢气,中学阶段学习的能和氢氧化钠溶液反应生成氢气的金属只有Al,所以A是Al,乙是NaAlO2,铝和单质B反应生成甲,甲中含有铝元素,甲是电解质,能和氢氧化钠溶液,则甲是Al2O3,B是O2,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,则丙是H2O,偏铝酸钠和二氧化碳反应生成氢氧化铝和碳酸氢钠,丁失去水生成氧化铝,则丁是Al(OH)3,
(1)由以上分析可知B为O2,乙为NaAlO2,故答案为:O2;NaAlO2;
(2)A为Al,位于周期表第三周期第ⅢA族,丙为水属于共价化合物,水的电子式是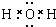 ,故答案为:第三周期第ⅢA族;
,故答案为:第三周期第ⅢA族;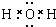 ;
;
(3)①铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②偏铝酸钠和过量二氧化碳反应生成氢氧化铝和碳酸氢钠,离子反应方程式为:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-,
故答案为:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-;
(4)A为Al为金属晶体、B为氧气形成分子晶体、丙为水形成分子晶体,三种物质的熔点由高到低的顺序为Al>H2O>O2,
故答案为:Al>H2O>O2.
点评 本题以无机推断为载体考查了铝及其化合物之间的转化,明确铝及其化合物的性质是解本题关键,注意铝和氢氧化钠溶液反应、偏铝酸钠和二氧化碳反应方程式的书写,为易错点,题目难度中等.

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案| A. | 煤油 | B. | 水 | C. | 酒精 | D. | 氯化钠溶液 |
| A. | 酒精及其他易燃物小面积失火,应该迅速使用湿抹布扑盖;钠、钾等失火应用泡沫灭火器扑灭 | |
| B. | 用排水法收集气体时,先撤酒精灯后移出导管 | |
| C. | 少量氢氧化钠溶液沾在皮肤上,立即用水冲洗,再涂碳酸氢钠溶液 | |
| D. | 有大量的氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向高处跑 |
| A. | P4(白磷、s)+3O2(g)═2P2O3(s)△H=-1638 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3 kJ/mol | |
| C. | 2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol | |
| D. | H2(g)+1/2O2(g)═H2O(l)△H=-285.8 kJ/mol |
| A. | 根据是否有丁达尔现象将分散系分为:溶液、胶体、浊液 | |
| B. | 酸性氧化物一定是非金属氧化物 | |
| C. | 强电解质的导电能力一定比弱电解质强 | |
| D. | 双氧水、水玻璃、氯水都是混合物 |
| A. | 氯、溴、碘 | B. | 食盐、淡水 | C. | 烧碱、氢气 | D. | 钠、镁、铝 |
| A. | 钢铁发生析氢腐蚀时,负极反应是Fe-3e-=Fe3+ | |
| B. | 钢铁发生析氧腐蚀的时候正极反应是2H2O+O2+e-═4OH- | |
| C. | 钢管与电源负极相连时,钢管可被保护 | |
| D. | 在入海口的钢铁闸门上装一定数量的铜块,可防止闸门被腐蚀 |