题目内容
12.下列物质加入金属钠,不反应的是( )| A. | 煤油 | B. | 水 | C. | 酒精 | D. | 氯化钠溶液 |
分析 A、煤油的成分为烃的混合物不能和钠发生反应;
B、钠和水剧烈反应;
C、甲醇中含有官能团羟基,能够与金属钠反应生成氢气;
D、钠与氯化钠溶液中的水发生反应.
解答 解:A、煤油的成分为烃的混合物不能和钠发生反应,故A符合;
B、钠和水剧烈反应生成氢氧化钠和氢气,故B不符合;
C、乙醇中含有官能团羟基,能够与金属钠反应生成氢气,故C不符合;
D、钠与氯化钠溶液中的水发生反应生成氢氧化钠和氢气,故D不符合.
故选A.
点评 本题考查金属钠的化学性质、有机物的官能团结构及化学性质,题目难度不大,注意掌握有机物结构及化学性质,选项C为易错点,明确乙醇的组成是解答关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列中心原子采取sp2杂化且为非极性分子的是( )
| A. | CS2 | B. | H2S | C. | SO2 | D. | SO3 |
9.下列反应的离子方程式书写正确的是( )
| A. | 明矾溶液中加入过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 铜粉与98.3%的硫酸加热下反应 Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 澄清石灰水中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
4.下列反应属于氧化还原反应的是( )
| A. | H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$H2O+Cu | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | ||
| C. | Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
1.已知:
(1)工业制镁时,电解MgCl2而不电解MgO的原因是MgO的熔点比MgCl2的熔点高,MgO熔融时耗费更多能源,增加成本;
(2)制铝时,电解Al2O3而不电解AlCl3的原因是是共价化合物,熔融态时不电离,难导电.
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2 800 | 2 050 | 714 | 191 |
(2)制铝时,电解Al2O3而不电解AlCl3的原因是是共价化合物,熔融态时不电离,难导电.
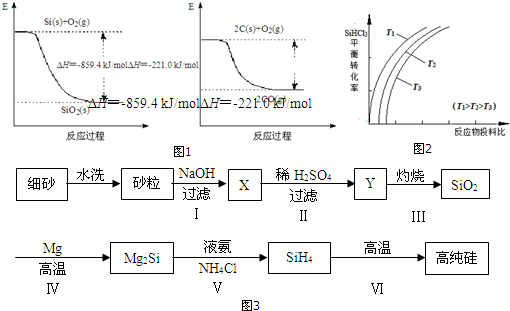
 如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答下列问题:
如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答下列问题: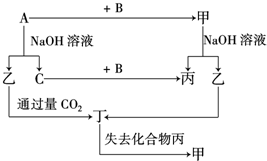 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图所示的转换关系,已知C为密度最小的气体,甲是电解质.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图所示的转换关系,已知C为密度最小的气体,甲是电解质.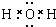 .
.