题目内容
14.下列说法正确的是( )| A. | 根据是否有丁达尔现象将分散系分为:溶液、胶体、浊液 | |
| B. | 酸性氧化物一定是非金属氧化物 | |
| C. | 强电解质的导电能力一定比弱电解质强 | |
| D. | 双氧水、水玻璃、氯水都是混合物 |
分析 A.根据分散系微粒直径的大小,将分散系分为溶液、胶体和浊液;
B.只能和碱反应生成只盐和水的氧化物是酸性氧化物;
C.溶液导电能力取决于溶液中离子浓度的大小,与电解质强弱无关;
D.只有一种成分组成的物质属于纯净物.
解答 解:A.根据分散系微粒直径的大小,将分散系分为溶液、胶体和浊液,分散质粒子直径在1nm~100nm之间的分散系属于胶体,不是根据否具有丁达尔现象,故A错误;
B.酸性氧化物也可能是金属氧化物,如:Mn2O7是酸性氧化物,故B错误;
C.溶液导电能力取决于溶液中离子浓度的大小,与电解质强弱无关,强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强,故C错误;
D.双氧水是过氧化氢的水溶液、水玻璃是硅酸钠的水溶液、氯水是氯气的水溶液,都是混合物,故D正确;
故选D.
点评 本题考查了分散系分类、氧化物、纯净物的概念及导电能力影响因素,概念的辨析是学习的难点,题目难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
4.下列反应属于氧化还原反应的是( )
| A. | H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$H2O+Cu | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | ||
| C. | Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
9.一定温度下,向一个容器为2L的真空密闭容器中通入2molN2和6molH2,3min后,测得容器内的压强是开始时的0.7倍,则这段时间内v(H2)为( )
| A. | 0.2mol•L-1•min-1 | B. | 0.6mol•L-1•min-1 | ||
| C. | 1.8mol•L-1•min-1 | D. | 3.6mol•L-1•min-1 |
19.下列各项表述中正确的是( )
| A. | Na2O2中阴离子和阳离子数目比为1:1 | |
| B. | 任何离子键的形成过程都有电子的得失 | |
| C. | 已知C(石墨)=C(金刚石)是吸收能量的反应,由此说明石墨比金刚石稳定 | |
| D. | 通过测量AlCl3溶液的导电性,可判断其为共价化合物 |
3.乙烯酮(CH2=C=O)在一定条件下能与含活泼氢的化合物发生加成反应,反应可表示为CH2=C=O+HA→CH3-CO-A.乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是( )
| A. | 与HCl加成生成CH3COCl | B. | 与H2O加成生成CH3COOH | ||
| C. | 与CH3COOH加成生成CH3COOCOCH3 | D. | 与CH3OH加成生成CH3COCH2OH |
4.根据你的实验观察和记录,下面关于Na2CO3和NaHCO3性质的叙述,正确的是( )
| A. | 受热时Na2CO3比NaHCO3稳定 | |
| B. | 同温同压下,在水中Na2CO3比NaHCO3溶解性小 | |
| C. | 物质的量相等的Na2CO3和NaHCO3分别溶于等体积的水后,Na2CO3水溶液的碱性较弱 | |
| D. | 质量相等的Na2CO3和NaHCO3分别与足量盐酸反应,Na2CO3放出的CO2少 |
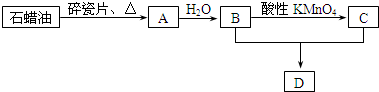
 CH3CH2OH反应类型是加成反应;B+C→D的化学方程式为:CH3COOH+C2H5OH
CH3CH2OH反应类型是加成反应;B+C→D的化学方程式为:CH3COOH+C2H5OH  CH3COOC2H5+H2O.反应类型是酯化反应或取代反应;
CH3COOC2H5+H2O.反应类型是酯化反应或取代反应;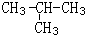 .
.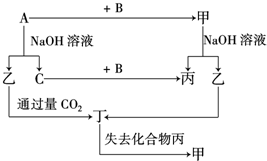 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图所示的转换关系,已知C为密度最小的气体,甲是电解质.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图所示的转换关系,已知C为密度最小的气体,甲是电解质.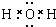 .
.
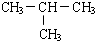 ,它的一氯取代产物有2种.
,它的一氯取代产物有2种.