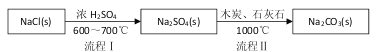
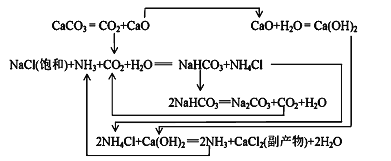
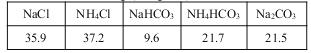
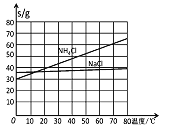
题目内容
【题目】CuCl是应用广泛的有机合成催化剂,工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl—)为原料生产CuCl的流程如下:
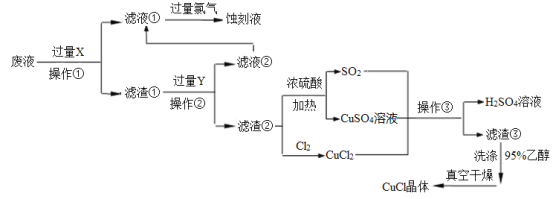
已知:CuCl是一种白色粉末,微溶于水,不溶于乙醇及稀硫酸,在水溶液中存在平衡:
CuCl(白色)+2Cl-![]() [CuCl3]2-(无色溶液);在空气中迅速被氧化成绿色;见光则分解,变成褐色。
[CuCl3]2-(无色溶液);在空气中迅速被氧化成绿色;见光则分解,变成褐色。
根据以上信息回答下列问题:
(1)试剂X是______,检验刻蚀液中金属阳离子的化学试剂是_____。(均填化学式)
(2)操作①、②、③相同,名称是________,所需要的主要玻璃仪器有烧杯、___ 、_____。
(3)滤渣①与Y反应的离子方程式为_________________。
(4)产生CuCl的化学方程式为_______________,当观察到 现象,即表明反应已经完全。
(5)在操作③之前往往向反应后的溶液中加入大量的水,其作用是 。
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_________。
【答案】
(1)Fe(1分) KSCN(或其他合理答案) (1分)
(2)过滤(1分) 玻璃棒、漏斗(2分)
(3)Fe+2H+=Fe2++H2↑(2分)
(4)CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4(3分) 溶液由蓝色变为无色(1分)
(5)稀释,促进平衡CuCl(白色)+2Cl-![]() [CuCl3]2-(无色溶液)逆向移动,生成CuCl(2分)
[CuCl3]2-(无色溶液)逆向移动,生成CuCl(2分)
(6)防止CuCl的氧化和见光分解(2分)
【解析】
试题分析:向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl—)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁的活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜;
(1)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜,过滤后滤渣中含有铜和铁,加入盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,将铜分离出来;氯化亚铁溶液中通入氯气生成氯化铁,检验铁离子的试剂是KSCN溶液;
(2)操作①、②、③均是过滤,所需要的主要玻璃仪器有烧杯、玻璃棒和漏斗。
(3)滤渣①与盐酸反应的离子方程式为Fe+2H+=Fe2++H2↑。
(4)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,产生CuCl的化学方程式依据得失电子守恒得到CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4,硫酸铜溶液是蓝色的,所以当观察到溶液由蓝色变为无色时即表明反应已经完全。
(5)因为CuCl在水溶液中存在平衡:CuCl(白色)+ 2Cl-![]() [CuCl3]2-(无色溶液),加水稀释,使平衡逆向移动,从而生成CuCl沉淀。
[CuCl3]2-(无色溶液),加水稀释,使平衡逆向移动,从而生成CuCl沉淀。
(6)氯化亚铜具有还原性,易被氧化而变质,见光易分解,所以生产中应防止CuCl的氧化和见光分解,减少产品CuCl的损失。