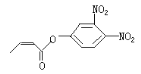
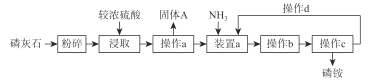
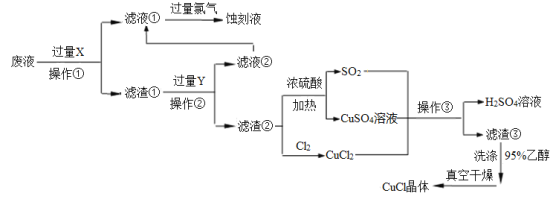
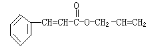题目内容
【题目】可逆反应:2NO2![]() 2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2;
②单位时间内生成n molO2的同时生成2n mol NO;
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态;
④混合气体中![]() 不变;
不变;
⑤混合气体的颜色不再改变的状态;
⑥混合气体的密度不再改变的状态;
⑦混合气体的平均相对分子质量不再改变的状态.
A. ①⑤⑥ B. ①④⑤⑦ C. ①⑤⑥⑦ D. ①③⑤⑥⑦
【答案】B
【解析】试题分析:①根据单位时间内生成nmolO2的同时生成2nmol NO2 ,可知生成氧气的速率和消耗速率相等,达到了平衡状态,故①正确;②单位时间内生成nmolO2的同时生成2nmol NO,都是正反应速率,无法判断是否达到平衡,故②错误;③任何情况下,同一反应方向、同一时间段内用NO2、NO、O2的物质的量浓度变化表示的反应速率的比均为2:2:1,如果不是同一反应方向,只有达到平衡中同时才符合该比值,故③错误;④混合气体中![]() 不变,说明各物质的含量不再变化,反应已达到平衡状态,故④正确;⑤混合气体颜色不再改变,说明生成的二氧化氮和消耗的速率相等,反应达到了平衡状态,故⑤正确;⑥反应前后混合气体总质量不变、容器体积不变,所以混合气体的密度始终不变,不能判断反应达到平衡状态,故⑥错误;⑦反应物和生成物都是气体,反应前后气体质量不变,物质的量不同,平均相对分子质量不再改变,说明反应达到平衡状态,故⑦正确。综上所述,选项B正确。
不变,说明各物质的含量不再变化,反应已达到平衡状态,故④正确;⑤混合气体颜色不再改变,说明生成的二氧化氮和消耗的速率相等,反应达到了平衡状态,故⑤正确;⑥反应前后混合气体总质量不变、容器体积不变,所以混合气体的密度始终不变,不能判断反应达到平衡状态,故⑥错误;⑦反应物和生成物都是气体,反应前后气体质量不变,物质的量不同,平均相对分子质量不再改变,说明反应达到平衡状态,故⑦正确。综上所述,选项B正确。

【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | b | ||||||||||||||||
c | d | e | |||||||||||||||
f | g | ||||||||||||||||
试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为 ,中心原子的杂化形式为 ;d的最高价氧化物的分子构型为 ,中心原子的杂化形式为 ,该分子是 (填“极性”或“非极性”)分子。
(2)b、d、e三种元素的氢化物中的沸点最高的是 ,原因是: 。
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式(必须将配位键表示出来) 。
(4)f(NH3)5BrSO4可形成两种配合物 ,已知f3+ 的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为 ,该配合物的配体是 、 ;