题目内容
【题目】碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料。请根据题意回答下列问题:
Ⅰ.世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法。其流程如下:
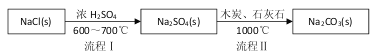
(1)流程I的另一产物是____,流程Ⅱ的反应分步进行:a. ![]()
b.Na2S与石灰石发生复分解反应,总反应方程式可表示为__________________。
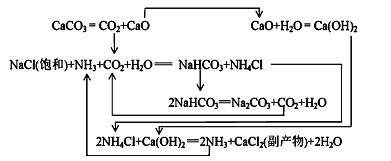
Ⅱ.1862年,比利时人索尔维(ErnestSolvay)用氨碱法生产碳酸钠。反应原理如下:
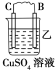
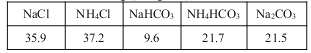
20℃时一些物质在水中的溶解度/g(100gH2O)
(2)氨碱法生成纯碱的原料是____________,可循环利用的物质有____________。
(3)饱和NaCl溶液通NH3和CO2能生成NaHCO3的原因有:_________、__________、_________。
Ⅲ.我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率。
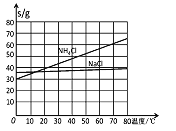
(4)生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在________(填温度范围)下析出________(填化学式)。
【答案】(1)HCl;Na2SO4+4C +CaCO3 ![]() Na2CO3+CaS+4CO↑;
Na2CO3+CaS+4CO↑;
(2)食盐、石灰石、NH3; CaO、CO2、NH4Cl (多答Ca(OH)2和NH3不扣分)
(3)反应体系中NaHCO3溶解度最小,反应消耗水,NaHCO3相对分子质量最大;(4) 0~10℃;NH4Cl;
【解析】
试题分析:(1)流程I中氯化钠与浓硫酸在加热时反应生成硫酸钠和氯化氢,流程Ⅱ的反应分步进行:a. ![]() b.Na2S与石灰石发生复分解反应,反应的总反应方程式为Na2SO4+4C +CaCO3
b.Na2S与石灰石发生复分解反应,反应的总反应方程式为Na2SO4+4C +CaCO3 ![]() Na2CO3+CaS+4CO↑,故答案为:HCl;Na2SO4+4C +CaCO3
Na2CO3+CaS+4CO↑,故答案为:HCl;Na2SO4+4C +CaCO3 ![]() Na2CO3+CaS+4CO↑;
Na2CO3+CaS+4CO↑;
(2)根据流程图,氨碱法生成纯碱的原料有食盐、石灰石、NH3;,可循环利用的物质有CaO、CO2、NH4Cl,故答案为:食盐、石灰石、NH3; CaO、CO2、NH4Cl;
(3)饱和NaCl溶液通NH3和CO2能生成NaHCO3是因为反应体系中NaHCO3溶解度最小,反应消耗水,NaHCO3相对分子质量最大,故答案为:反应体系中NaHCO3溶解度最小,反应消耗水,NaHCO3相对分子质量最大;
(4)根据溶解度曲线,生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在0~10℃下析出氯化铵晶体,故答案为:0~10℃;NH4Cl。