题目内容
10.根据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)画出原电池示意图并在图中加入电流表,注明电极材料名称和电解质溶液,其中盐桥为琼脂-饱和KNO3盐桥.
请回答下列问题:
(1)银电极为电池的正极,写出两电极的电极反应式:
Ag电极:2Ag++2e-═2Ag;
Cu电极:Cu-2e-═Cu2+.
(2)外电路中的电子是从Cu电极流向Ag电极.
(3)盐桥中向CuSO4溶液中迁移的离子是B(填序号).
A.K+ B.NO3- C.Ag+ D.SO42-.
分析 (1)根据电池反应式知,该反应中Ag元素化合价由+1价变为0价、Cu元素化合价由0价变为+2价,所以Cu发生氧化反应、银离子发生还原反应,则Cu作负极、Ag作正极;
(2)外电路中,电子从负极沿导线流向正极;
(3)放电时,盐桥中阴离子向负极移动、阳离子向正极移动.
解答 解:(1)根据电池反应式知,该反应中Ag元素化合价由+1价变为0价、Cu元素化合价由0价变为+2价,所以Cu发生氧化反应、银离子发生还原反应,则Cu作负极、Ag作正极,正负极反应式分别为2Ag++2e-═2Ag、Cu-2e-═Cu2+,含有盐桥的原电池中,电极材料与其相应的电解质溶液具有相同金属元素,所以原电池图为 ,故答案为:正;2Ag++2e-═2Ag;Cu-2e-═Cu2+;
,故答案为:正;2Ag++2e-═2Ag;Cu-2e-═Cu2+; ;
;
(2)Cu是负极、Ag是正极,外电路中电子从负极Cu沿导线流向正极Ag,故答案为:Cu;Ag;
(3)放电时,盐桥中阴离子向负极移动、阳离子向正极移动,硫酸铜溶液所在的电极是负极,所以阴离子硝酸根离子向硫酸铜溶液移动,故选B.
点评 本题以原电池原理为载体考查原电池设计,明确原电池原理是解本题关键,根据电池反应式中元素化合价变化确定正负极及电解质溶液,一般来说,发生氧化反应的金属作负极、发生还原反应的电解质溶液为原电池电解质溶液,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
7.下列是元素周期表的一部分
根据以上元素在周期表中的位置,用化学式填写空白.
(1)单质中氧化性最强的是F2,其电子式是 ;化学性质最不活泼的是Ne,A与D形成的阳离子的电子式是
;化学性质最不活泼的是Ne,A与D形成的阳离子的电子式是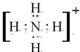 .
.
(2)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是NaOHAl(OH)3H3PO4HClO4;
(3)B元素可以形成两种氧化物,分别写出两种氧化物的电子式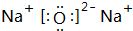 ,
,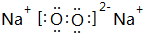 .其中B元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,有0.15mol 电子发生转移.
.其中B元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,有0.15mol 电子发生转移.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | A | |||||||
| 二 | D | F | H | |||||
| 三 | B | C | E | G |
(1)单质中氧化性最强的是F2,其电子式是
 ;化学性质最不活泼的是Ne,A与D形成的阳离子的电子式是
;化学性质最不活泼的是Ne,A与D形成的阳离子的电子式是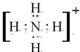 .
.(2)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是NaOHAl(OH)3H3PO4HClO4;
(3)B元素可以形成两种氧化物,分别写出两种氧化物的电子式
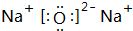 ,
, .其中B元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,有0.15mol 电子发生转移.
.其中B元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,有0.15mol 电子发生转移.
5.下列关于反应:XeF4+2CH3-CH=CH2?→2CH3CH2-CHF2+Xe的说法正确的是( )
| A. | XeF4被氧化 | B. | 该反应是非氧化还原反应 | ||
| C. | XeF4既是氧化剂又是还原剂 | D. | CH3-CH=CH2是还原剂 |
2.下列说法正确的是( )
| A. | 2NO(g)+2CO(g)═N2(g)+2CO2(g)该反应是熵减的反应 | |
| B. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率减慢 | |
| C. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| D. | 由H2(g)+1/2O2(g)═H2O(g)△H=-241.8 kJ•mol-1,得出H2的燃烧热是241.8 kJ•mol-1 |
19.下列化学式及结构式中,从成键情况看不合理的是( )
| A. | CH4Si: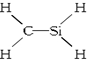 | B. | CH4S: | C. | CH2SeO: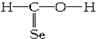 | D. | CH3N: |
20.关于下列图示装置的描述中,不正确的是( )
| A. | 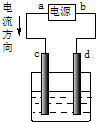 c为阳极,d为阴极 | |
| B. | 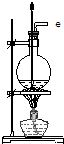 用于实验室蒸馏石油 | |
| C. | 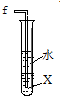 X为CCl4时,可用于吸收氯化氢气体,并防止倒吸 | |
| D. | 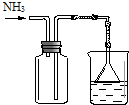 用于收集氨气及并进行尾气吸收 |
 某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.
某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.