题目内容
15.在①H2、②NaCl、③H2O、④Na2O2、⑤H2O2、⑥NH4Cl、⑦CO2、⑧NH4NO3、⑨Na2O、⑩HCl这十种物质中,只含有离子键的是②⑨(填序号,下同),只含有共价键的是①③⑤⑦⑩,既含有离子键又含有共价键的是④⑥⑧,属于离子化合物的是②④⑥⑧⑨,属于共价化合物的是③⑤⑦⑩.分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,含离子键的一定为离子化合物,只含共价键的化合物为共价化合物,以此来解答.
解答 解:①H2中含H-H共价键,为单质;
②NaCl中只含离子键,为离子化合物;
③H2O中只含H-O共价键,为共价化合物;
④Na2O2中含离子键和O-O非极性共价键,为离子化合物;
⑤H2O2中含极性键和非极性键,为共价化合物;
⑥NH4Cl中含离子键和N-H极性键,为离子化合物;
⑦CO2中含C、O之间的极性共价键,为共价化合物;
⑧NH4NO3中含离子键和极性共价键,为离子化合物;
⑨Na2O中只含离子键,为离子化合物;
⑩HCl中含H-Cl共价键,为共价化合物,
只含有离子键的是②⑨,只含有共价键的是①③⑤⑦⑩,既含有离子键又含有共价键的是④⑥⑧,属于离子化合物的是②④⑥⑧⑨,属于共价化合物的是③⑤⑦⑩,
故答案为:②⑨;①③⑤⑦⑩;④⑥⑧;②④⑥⑧⑨;③⑤⑦⑩.
点评 本题考查化学键,为高频考点,把握化学键的形成及化学键判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中化学键,题目难度不大.

练习册系列答案
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
12.下表是元素周期表的一部分,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为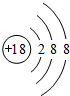 ;
;
(2)写出①元素的单质分子的电子式 ;用电子式表示元素②与⑪化合物的形成过程
;用电子式表示元素②与⑪化合物的形成过程 ,该化合物属于共价(填“共价”或“离子”)化合物.
,该化合物属于共价(填“共价”或“离子”)化合物.
(3)碱性最强的化合物的电子式是: ;
;
(4)②元素氢化物在常温下和③发生反应所得溶液的pH>7
(5)元素③与 ⑩形成化合物的化学式是NaCl,高温灼烧该化合物时,火焰呈黄色.
(6)元素⑦与⑩两者核电荷数之差是18.
(7)比较元素⑦、⑨、⑩原子的半径大小K>Br>Cl
(8)③④⑤单质的活泼性顺序为:Na>Mg>Al(从大到小,判断的实验依据是:与酸反应的剧烈程度(任写一种)
(9)请设计一个实验方案,比较⑦和⑩单质氧化性的强弱:Cl2+2Br-=Br2+2Cl-.
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 二 | ⑪ | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;(2)写出①元素的单质分子的电子式
 ;用电子式表示元素②与⑪化合物的形成过程
;用电子式表示元素②与⑪化合物的形成过程 ,该化合物属于共价(填“共价”或“离子”)化合物.
,该化合物属于共价(填“共价”或“离子”)化合物.(3)碱性最强的化合物的电子式是:
 ;
;(4)②元素氢化物在常温下和③发生反应所得溶液的pH>7
(5)元素③与 ⑩形成化合物的化学式是NaCl,高温灼烧该化合物时,火焰呈黄色.
(6)元素⑦与⑩两者核电荷数之差是18.
(7)比较元素⑦、⑨、⑩原子的半径大小K>Br>Cl
(8)③④⑤单质的活泼性顺序为:Na>Mg>Al(从大到小,判断的实验依据是:与酸反应的剧烈程度(任写一种)
(9)请设计一个实验方案,比较⑦和⑩单质氧化性的强弱:Cl2+2Br-=Br2+2Cl-.
3.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,28gCH2=CH2含有NA个碳原子 | |
| B. | 1mol苯含有3NA个碳碳单键和3NA个碳碳双键 | |
| C. | 标准状况下,22.4L正戊烷含有12NA个氢原子 | |
| D. | 常温常压下,16gCH4含有4NA个共价键 |
20.某高分子化合物R的结构简式为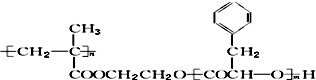 ,下列有关R的说法正确的是( )
,下列有关R的说法正确的是( )
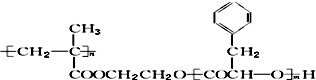 ,下列有关R的说法正确的是( )
,下列有关R的说法正确的是( )| A. | R的一种单体的分子式可能为C9H10O2 | |
| B. | R完全水解后生成物均为小分子有机物 | |
| C. | 可以通过加聚反应和缩聚反应合成R | |
| D. | 碱性条件下,1 mol R完全水解消耗NaOH的物质的量为2 mol |
4.关于结构简式为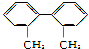 的烃的下列说法正确的是( )
的烃的下列说法正确的是( )
 的烃的下列说法正确的是( )
的烃的下列说法正确的是( )| A. | 分子中至少有6个碳原子共平面 | B. | 分子中至少有8个碳原子共平面 | ||
| C. | 分子中至少有9个碳原子共平面 | D. | 分子中至少有14个碳原子共平面 |
5.下列分子中,键的极性最强的是( )
| A. | PH3 | B. | H2S | C. | HBr | D. | HCl |

 .
.