题目内容
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如下表。

①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
【答案】(1)①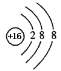 ;②C+2H2SO4(浓)
;②C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O;
2SO2↑+CO2↑+2H2O;
(2)①0.043;②5。
(3)①![]() ;②c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
;②c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
③H2SO3+HCO3-=HSO3-+CO2↑+H2O
【解析】
试题分析:(1)①S是16号元素。S原子获得2个电子变为S2-,硫离子的结构示意图为 。
。
②加热时,浓硫酸与木炭发生反应产生SO2、CO2和水,反应的化学方程式为C+2H2SO4(浓)![]() 2SO2↑ +CO2↑+2H2O;
2SO2↑ +CO2↑+2H2O;
(2)①根据图像可知,在pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol·L-1H2S溶液中,根据S元素守恒可知:c(S2-)+ c(H2S)+c(HS-)=0.1 mol/L,而c(S2-)=5.7×10-2mol/L,因此c(H2S)+c(HS-)=0.1 mol/L -5.7×10-2 mol/L=0.043 mol/L。
②由于Ksp(MnS)=2.8×10-23,在某溶液c(Mn2+)=0.020 mol·L-1,则开始形成沉淀需要的S2-的浓度是c(S2-)= Ksp(MnS)÷c(Mn2+)=2.8×10-13÷0.020 mol/L=1.4×10-11 mol/L,根据图像中c(S2-)与溶液的pH关系可知,此时溶液pH=5,Mn2+开始形成沉淀。
(3)①根据电离平衡常数的含义可知HSO3-的电离平衡常数表达式是 。
。
②Na2SO3在溶液中电离的方程式是Na2SO3=2Na++SO32-,该盐是强碱弱酸盐,弱酸根离子SO32-发生水解反应:SO32-+H2O![]() HSO3-+OH-,水解产生的HSO3-又有部分发生水解反应:HSO3-+H2O
HSO3-+OH-,水解产生的HSO3-又有部分发生水解反应:HSO3-+H2O![]() H2SO3 +OH-,水解是逐步进行的,而且在溶液中还存在水的电离平衡,但是盐水解程度是微弱的,主要以盐电离产生的离子存在,所以0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。
H2SO3 +OH-,水解是逐步进行的,而且在溶液中还存在水的电离平衡,但是盐水解程度是微弱的,主要以盐电离产生的离子存在,所以0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。
③由于多元弱酸分步电离,电离程度:一级电离>二级电离,电离程度越大,电离平衡常数就越大。所以根据表格数据可知H2SO3的二级电离平衡常数大于H2CO3的一级电离平衡常数,故H2SO3溶液和NaHCO3溶液反应的主要是复分解反应的规律:强酸与弱酸的盐发生反应制取弱酸。其离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O。




