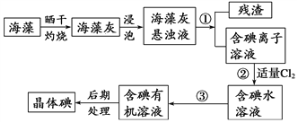
题目内容
【题目】回答下列问题
(1)质量比为16∶7∶ 6的三种气体 SO2、CO、NO,分子个数之比为________;相同条件下体积比为________。
(2)在标准状况下,1.7 g NH3所占的体积为________L,它与标准状况下________L H2S含有相同数目的H原子。
(3)某气体氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为________,R的相对原子质量为________。
【答案】5:5:45:5:42.243.3664g/mol32
【解析】
(1)质量比为16∶7∶ 6的三种气体SO2、CO、NO物质的量之比为16/64:7/27:6/30=5:5:4,故三者分子数目之比为5:5:4 , 根据阿伏伽德罗定律在相同条件下体积比等于物质的量之比,所以体积比为5:5:4。 因此答案是: 5:5:4 5:5:4 。
(2) 1.7 g氨气物质的量为1.7 g/ 17 g![]() mol-1=0.1mol ,氨气体积为0.1mol
mol-1=0.1mol ,氨气体积为0.1mol![]() 22.4L/mol=2.24L ,与含有相同H原子数目的硫化氢的物质的量为
22.4L/mol=2.24L ,与含有相同H原子数目的硫化氢的物质的量为![]() mol标准状况下H2S的体积为:0.15mol
mol标准状况下H2S的体积为:0.15mol![]() =3.36L因此,本题正确答案是:2.24; 3.36;
=3.36L因此,本题正确答案是:2.24; 3.36;
(3)氧化物的物质的量为(448 mL![]() 10-3)/ 22.4L
10-3)/ 22.4L![]() mol-1=0.02mol氧化物的摩尔质量为1.28 g /0.02mol=64g/mol,R的相对原子质量为64-32=32,因此,本题正确答案是64g/mol:;32.
mol-1=0.02mol氧化物的摩尔质量为1.28 g /0.02mol=64g/mol,R的相对原子质量为64-32=32,因此,本题正确答案是64g/mol:;32.

练习册系列答案
相关题目