题目内容
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ/mol N2(g) +2O2(g) = 2NO2(g)△H = +133kJ/mol、H2O(g) = H2O(l) △H = -44kJ/mol。催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为_____________________。
Ⅱ.脱碳:向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l) △H < 0
CH3OH(l) + H2O(l) △H < 0
(1)①该反应自发进行的条件是__________(填“低温”、“高温”或“任意温度”),
②下列叙述能说明此反应达到平衡状态的是___________。
a.混合气体的平均式量保持不变 ;b.CO2和H2的体积分数保持不变;
c. CO2和H2的转化率相等 ;d.混合气体的密度保持不变
e.1molCO2生成的同时有3molH—H键断裂
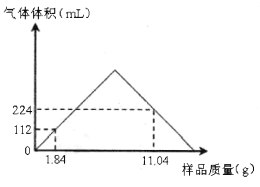
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6内CO2的浓度随时间的变化_____。

(2)改变温度,使反应CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) △H < 0中的所有物质都为气态。起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g) + H2O(g) △H < 0中的所有物质都为气态。起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:

①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)_______K(II)(填“>”、“<”或“=”,下同);平衡时CH3OH的浓度c(I)_______c(II)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=_______________。在其它条件不变下,若30min时只改变温度为T2 ℃,此时H2的物质的量为3.2mol,则T1______T2(填“>”、“<”或“=”)。若30min时向容器中再充入1molCO2和1molH2O(g),则平衡_________移动(填“正向”、“逆向”或“不”)。
【答案】 ![]() 低温 de
低温 de  < <
< < ![]() < 不
< 不
【解析】Ⅰ. 在催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质,无毒物质为N2,已知:H2的燃烧热为285.8kJ/mol,则① H2(g)+1/2O2(g)=H2O(l) △H=285.8kJ/mol、② N2(g)+2O2(g)=2NO2(g) △H=+133kJ/mol、③ H2O(g)=H2O(l) △H=44kJ/mol,①×4②③×4得H2还原NO2生成水蒸气和N2的热化学方程式为:4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H=1100.2kJ/mol,故答案为:4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H=1100.2kJmol1;
Ⅱ.(1).①. CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l) △H < 0,该反应的熵变△S<0,则低温下满足△HT△S<0,故答案为:低温;
CH3OH(l) + H2O(l) △H < 0,该反应的熵变△S<0,则低温下满足△HT△S<0,故答案为:低温;
②. 向2L密闭容器中加入2molCO2、6molH2,发生反应CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l) △H < 0,a. 因混合气体的平均式量始终保持不变,所以混合气体的平均式量保持不变不能说明反应达到平衡状态,故a错误;b. 向2L密闭容器中加入2molCO2、6molH2,按照1:3反应,所以反应过程中CO2和H2的体积分数始终保持不变,不能说明反应达到平衡状态,故b错误;c. 向2L密闭容器中加入2molCO2、6molH2,按照1:3反应,CO2和H2的转化率始终相等,不能确定反应是否达到平衡状态,故c错误;d. 反应物是气体,生成物是液体,混合气体的密度保持不变,说明反应达到平衡状态,故d正确;e. 1mol CO2生成的同时有3mol HH键断裂,说明正逆反应速率相等,反应达到平衡状态,故e正确;答案为:de;
CH3OH(l) + H2O(l) △H < 0,a. 因混合气体的平均式量始终保持不变,所以混合气体的平均式量保持不变不能说明反应达到平衡状态,故a错误;b. 向2L密闭容器中加入2molCO2、6molH2,按照1:3反应,所以反应过程中CO2和H2的体积分数始终保持不变,不能说明反应达到平衡状态,故b错误;c. 向2L密闭容器中加入2molCO2、6molH2,按照1:3反应,CO2和H2的转化率始终相等,不能确定反应是否达到平衡状态,故c错误;d. 反应物是气体,生成物是液体,混合气体的密度保持不变,说明反应达到平衡状态,故d正确;e. 1mol CO2生成的同时有3mol HH键断裂,说明正逆反应速率相等,反应达到平衡状态,故e正确;答案为:de;
③.在t2时将容器容积缩小一倍,压强增大,反应速率增大,二氧化碳的浓度增大,平衡正向进行,二氧化碳的浓度随后减小,t3时达到平衡,t4时降低温度,因该反应为放热反应,则平衡正向进行,二氧化碳的浓度减小,反应速率减小,t5时达到平衡;图象在t2的起点二氧化碳浓度突然增大为1mol/L,随反应进行减小,图中t3到t4终点平衡线在0.5mol/L的线上,t5以后在0.5mol/L的线以下,但不能到横坐标线上且有平衡线段,所以图象为: ,故答案为:
,故答案为: ;
;
(2).①. CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) △H < 0,反应Ⅰ的条件是恒温恒容,Ⅱ为恒容绝热,该反应是放热反应,由表中数据可知,若反应Ⅰ、Ⅱ均为恒温恒容,则达到相同的平衡状态,Ⅱ为逆向开始反应,温度降低,与反应I相比,相当于降低温度,平衡正向进行,平衡常数增大,平衡时甲醇的浓度增大,故答案为:<,<;
CH3OH(g) + H2O(g) △H < 0,反应Ⅰ的条件是恒温恒容,Ⅱ为恒容绝热,该反应是放热反应,由表中数据可知,若反应Ⅰ、Ⅱ均为恒温恒容,则达到相同的平衡状态,Ⅱ为逆向开始反应,温度降低,与反应I相比,相当于降低温度,平衡正向进行,平衡常数增大,平衡时甲醇的浓度增大,故答案为:<,<;
②. 对于反应I,由表中数据可知,10min时H2的物质的量为4.5mol,则甲醇的物质的量为n(CH3OH)=(6-4.5)mol÷3=0.5mol,则前10min内的平均反应速率v(CH3OH)=0.5mol÷2L÷10min=0.025mol·L-1·min-1;在30min时,根据三段式法有:
CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
起始量(mol) 2 6 0 0
转化量(mol) 1 3 1 1
30min量(mol) 1 3 1 1
若30min时只改变温度为T2℃,此时H![]() =
=![]() ,若30min时向容器中再充入1molCO2和1molH2O(g),此时Qc=
,若30min时向容器中再充入1molCO2和1molH2O(g),此时Qc=![]() =
=![]() =K,则平衡不移动,故答案为:0.025mol·L-1·min-1;<;不。
=K,则平衡不移动,故答案为:0.025mol·L-1·min-1;<;不。

 阅读快车系列答案
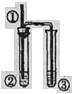
阅读快车系列答案【题目】用如图所示装置进行实验,实验现象与对应的结论均正确的是
装置 | ① | ② | 实验现象 | 结论 | |
| A | 铜丝 | 稀硝酸 | ②出现红棕色气体 | 硝酸与铜生成了NO2③中需要碱溶液吸收尾气 |
B | 底端灼热的碳棒 | 浓硝酸 | ②中出现红棕色气体 | 产生气体一定是混合气体 | |
C | 铜丝 | Fe2(SO4)3溶液 | ②中溶液黄色变浅 | Cu与Fe2(SO4)3溶液发生置换反应 | |
D | 铁丝 | 浓硫酸 | 无明显现象 | 铁与浓硫酸不反应 |
A. A B. B C. C D. D