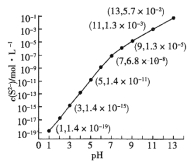
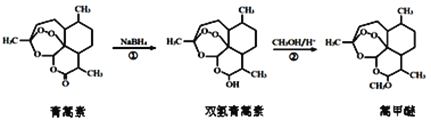
题目内容
【题目】下列物质不能做还原剂的是( )
A.H2S
B.Fe2+
C.Fe3+
D.SO2
【答案】C
【解析】解:A、H2S中S元素﹣2价,是最低价态可做还原剂,故A错误;
B、Fe2+的化合价是中间价态可做还原剂,故B错误;
C、Fe3+的化合价是最高价态只能做氧化剂,故C正确;
D、SO2中S元素是+4价,是中间价态可做还原剂,故D错误;
故选C.
根据元素的化合价高低判断物质具有氧化性还是还原性.最高价的元素只有氧化性,最低价的元素只有还原性,中间价态的元素既有氧化性又有还原性.

【题目】用如图所示装置进行实验,实验现象与对应的结论均正确的是
装置 | ① | ② | 实验现象 | 结论 | |
| A | 铜丝 | 稀硝酸 | ②出现红棕色气体 | 硝酸与铜生成了NO2③中需要碱溶液吸收尾气 |
B | 底端灼热的碳棒 | 浓硝酸 | ②中出现红棕色气体 | 产生气体一定是混合气体 | |
C | 铜丝 | Fe2(SO4)3溶液 | ②中溶液黄色变浅 | Cu与Fe2(SO4)3溶液发生置换反应 | |
D | 铁丝 | 浓硫酸 | 无明显现象 | 铁与浓硫酸不反应 |
A. A B. B C. C D. D
【题目】用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
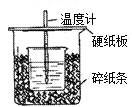
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
(2)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大、偏小、无影响”);盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热____________(填“偏大、偏小、无影响”);在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会____________(填“偏大”、“偏小”或“不变”)。
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会____________(填“偏大”、“偏小”或“不变”),其原因是_______________________________________________。
(4)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g·℃),则该反应的中和热为ΔH=_______。根据计算结果,写出该中和反应的热化学方程式______________________。
(5)实验中改用60 mL 1.0 mol·L-1的盐酸跟50 mL 1.1mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热__________ (填“相等”或“不相等”)。