��Ŀ����
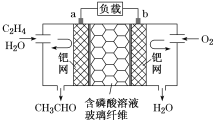
����Ŀ��ijʵ��С������FeS������Cu2+��Pb2+��ˮ��ķ������壨��Ҫ�ɷ�CuS��FeS��PbS��SiO2����ȡ��ͭ��Fe2��SO4��3���壬��ƵIJ����������£�

��1����߲���ٷ�Ӧ���ʵĴ�ʩ�����¶��⣬����_____________��дһ������
��2��������ˮʱ��FeS��Pb2+��Ӧ�����ӷ���ʽΪ____________��
��3������A����Ҫ�ɷ���_______________���ѧʽ����
��4��������У������Լ�xΪ____________�����ţ���
a��Cl2������b��H2O2������c��KMnO4 d��HNO3
��5��������ҺB��ȫת��Ϊ��ҺC���Լ���_________________________��
��6����ʪ������ļ�����ϸ�������£���ʯ���е���ͭ��������ת��Ϊ���ؽ����ε����Է�ˮ����Ԫ��ȫ��������Һ�У�����Ⱦ��������ת����Ӧ�����ӷ���ʽΪ____________��
��7����֪��������FeS��CuS��Ksp�ֱ�Ϊ6.5x10-18��1.3x10-36�������ù�����FeS������0.01mol��L-1 Cu2+�ķ�ˮ���������ˮ��c��Cu2+��=______mol��L-1����������仯����
���𰸡� �������гɷ�ĩ FeS(s)+Pb2+(aq)=PbS(S)+Fe2+(aq) SiO2 b ���Ը��������Һ CuS+8Fe3++4H2O ![]() Cu2++8Fe2++8H++SO42- 2��10-21
Cu2++8Fe2++8H++SO42- 2��10-21
����������1��Ϊ�˼ӿ췴Ӧ���ʣ����Բ�ȡ��ʩ�У��ʵ������¶����������гɷ�ĩ������Ӧ��ĽӴ�����ȡ���Ϊ���������гɷ�ĩ
��2��FeS��Pb2+���Է���������ת����FeSת��ΪPbS��������Ӧ�����ӷ���ʽΪ��FeS(s)+Pb2+(aq)=PbS(s)+Fe2+(aq) ��Ϊ��FeS(s)+Pb2+(aq)=PbS(s)+Fe2+(aq)
(3) SiO2������ϡ���ᣬ���Թ���A����Ҫ�ɷ���SiO2����Ϊ��SiO2
��4��������У������Լ�x���ܰ�Fe2+����ΪFe3+���ֲ��������������ʣ����ѡ��H2O2
����b
��5������ҺB��ȫת��Ϊ��ҺC������ҺB�в��ٺ���Fe2+�����������Ը��������Һ���顣������Fe2+�������Ը����������ɫ����������Fe2+�������Ը���������ޱ仯����Ϊ�����Ը��������Һ
��6��������֪������֪����Ӧ��Ϊ��ͭ����������ˮ��������ϸ�����������������������������ת����Ӧ�����ӷ���ʽΪ��CuS+8Fe3++4H2O ![]() Cu2++8Fe2++8H++SO42- ��Ϊ��CuS+8Fe3++4H2O
Cu2++8Fe2++8H++SO42- ����CuS+8Fe3++4H2O ![]() Cu2++8Fe2++8H++SO42-
Cu2++8Fe2++8H++SO42-
��7���ù�����FeS������0.01mol��L-1 Cu2+�ķ�ˮ�����ķ�ӦΪ��FeS(s)+Cu2+(aq)= CuS(s)+Fe2+(aq)�����ڷ�ˮ��c��Cu2+��=0.01mol��L-1�����Դ�����ķ�ˮ��c��Fe2+��=0.01mol��L-1��c��![]() ��=
��=![]() =
=![]() =6.5
=6.5![]() mol��L-1
mol��L-1
���c��Cu2+��=![]() =
=![]() =2
=2![]() mol��L-1 ����2��10-21
mol��L-1 ����2��10-21

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����50 mL 1.0 mol/L�����50 mL 1.1 mol/L ����������Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺

��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��________��
��2�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ__________(����ƫ��ƫС����Ӱ����)�������ڷ�Ӧ������Ϊ�з�������������������ڷ�Ӧ�лӷ������õ��к���____________(����ƫ��ƫС����Ӱ����)�����к��Ȳⶨʵ���д�����ˮϴ���¶ȼ��ϵ�����IJ��裬���˲������裬���õ��к��Ȼ�____________(����ƫ��������ƫС������������)��
��3�����õ�Ũ�ȵĴ�����NaOH��Һ��Ӧ�����õ��к��Ȼ�____________(����ƫ��������ƫС������������)����ԭ����_______________________________________________��
��4����ʵ��С����������ʵ�飬ÿ��ȡ��Һ��50 mL������¼��ԭʼ����(���±�)��
ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�(t2)/�� | �²�(t2��t1)/�� | ||
���� | NaOH��Һ | ƽ��ֵ | |||
1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
��֪���ᡢNaOH��Һ�ܶȽ���Ϊ1.00g/cm3���кͺ���Һ�ı�����c��4.18��10��3kJ/(g����)����÷�Ӧ���к���Ϊ��H��_______�����ݼ�������д�����кͷ�Ӧ���Ȼ�ѧ����ʽ______________________��
��5��ʵ���и���60 mL 1.0 mol��L-1�������50 mL 1.1mol��L-1��NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������_________�������������������������������к���__________ (��������������������)��