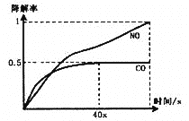
题目内容
【题目】已知海水提取镁的主要步骤如下:
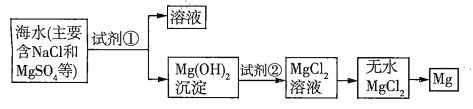
(1)关于加入试剂①作沉淀剂,有以下方法,请完成下列问题。
方法 | 是否合理 | 简述理由 |
方法:高温加热蒸发海水后,再加入沉淀剂 | a | b |
你认为合理的其他方法是c |
a. _____________;
b.____________;
c.____________。
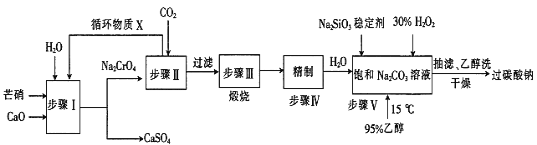
(2)框图中加入的试剂①应该是_______(填物质名称),加入试剂②的溶质是_______(填化学式)。工业上由无水![]() 制取镁的化学方程式为___________。
制取镁的化学方程式为___________。
【答案】不合理 能源消耗大,不经济 向海滩晒盐后得到的苦卤中加入沉淀剂 石灰乳 ![]()
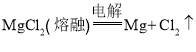
【解析】
(1)高温加热蒸发海水后,再加入沉淀剂,能源消耗大,不经济,可采用向海滩晒盐后得到的苦卤中加入沉淀剂;
(2)试剂①作沉淀剂,生成氢氧化镁沉淀,加入试剂②生成氯化镁,工业制镁采用电解熔融的氯化镁制取,以此分析。
(1)高温加热蒸发海水后,再加入沉淀剂,能源消耗大,不经济,可采用向海滩晒盐后得到的苦卤中加入沉淀剂,
故答案为:不合理;能源消耗大,不经济;向海滩晒盐后得到的苦卤中加入沉淀剂;
(2)试剂①应是石灰乳,发生的反应是![]() ;试剂②应是盐酸,发生的反应是
;试剂②应是盐酸,发生的反应是![]() ,然后经过浓缩、结晶、脱水得无水
,然后经过浓缩、结晶、脱水得无水![]() ,电解再电解熔融的
,电解再电解熔融的![]() 便可制得
便可制得![]() :
: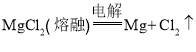 ,
,
故答案为:石灰乳;![]() ;
;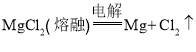 。
。

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目