题目内容
【题目】恒温下,容积均为2L的密闭容器M、N中,分别有以下列两种起始投料建立的可逆反应 ![]() 的化学平衡状态,相关数据如下:M:
的化学平衡状态,相关数据如下:M:![]() ; 2min达到平衡,生成
; 2min达到平衡,生成![]() ,测得从反应开始到平衡C的速率为
,测得从反应开始到平衡C的速率为![]() ;N:
;N:![]() ;达到平衡时
;达到平衡时![]() 下列推断的结论中不正确的是( )
下列推断的结论中不正确的是( )
A.![]() B.平衡时M中
B.平衡时M中![]()
C.![]() D.
D.![]()
【答案】D
【解析】
A、从反应开始到平衡,C的速率为![]() ,则△n(C)=
,则△n(C)=![]() ×2min×2L=1.2mol,物质的量之比等于化学计量数之比,所以2:
×2min×2L=1.2mol,物质的量之比等于化学计量数之比,所以2:![]() :
:![]() ,解得
,解得![]() ,A正确;
,A正确;
B、从反应开始到平衡,C的速率为![]() ,所以△c(C)=
,所以△c(C)=![]() ×2L=0.6mol/L,浓度变化量之比等于化学计量数之比,所以
×2L=0.6mol/L,浓度变化量之比等于化学计量数之比,所以![]() ,所以平衡时
,所以平衡时![]() ,B正确;
,B正确;
C、由B中计算可知M中A的平衡浓度为![]() ,所以M、N是等效平衡,则N平衡时C的物质的量也为1.2mol,C转化了2-1.2=0.8mol,所以D也转化了0.8mol。由于D是固体,所以起始时D的物质的量只要大于0.8mol即可,C正确;
,所以M、N是等效平衡,则N平衡时C的物质的量也为1.2mol,C转化了2-1.2=0.8mol,所以D也转化了0.8mol。由于D是固体,所以起始时D的物质的量只要大于0.8mol即可,C正确;
D、由C中分析可知y>0.8,故D错误;
故选D。

【题目】已知海水提取镁的主要步骤如下:
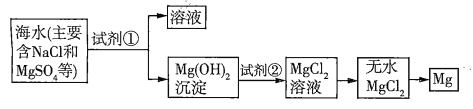
(1)关于加入试剂①作沉淀剂,有以下方法,请完成下列问题。
方法 | 是否合理 | 简述理由 |
方法:高温加热蒸发海水后,再加入沉淀剂 | a | b |
你认为合理的其他方法是c |
a. _____________;
b.____________;
c.____________。
(2)框图中加入的试剂①应该是_______(填物质名称),加入试剂②的溶质是_______(填化学式)。工业上由无水![]() 制取镁的化学方程式为___________。
制取镁的化学方程式为___________。
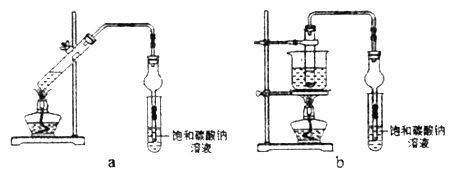
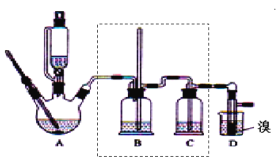
【题目】实验室制备1,2—二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2—二溴乙烷,装置如图所示。有关数据列表如表所示。回答下列问题:
乙醇 | 1,2—二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是__。
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置A中除了浓硫酸和乙醇外,还应加入__,其目的是__。装置A中生成副产物乙醚的化学反应方程式为__。
(3)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,为了验证SO2的存在并除去SO2对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放___。
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液 d.品红和酸性KMnO4
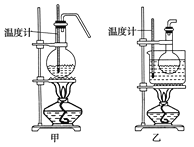
(4)甲、乙两装置均可用作实验室由无水乙醇制取乙烯,乙图采用甘油浴加热(甘油沸点290℃,熔点18.17℃),当甘油温度达到反应温度时,将盛有无水乙醇和浓硫酸混合液的烧瓶放入甘油中,很快达到反应温度。甲、乙两装置相比较,乙装置有哪些优点__,写出该实验中由无水乙醇制取乙烯的化学方程式___。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置后,产物应在__层;若产物中有少量副产物乙醚。可用__的方法除去。
【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。
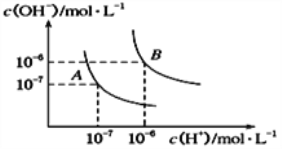
①100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液b.CH3COONa 溶液c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”);
(3)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-4 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=_________。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为__________________。