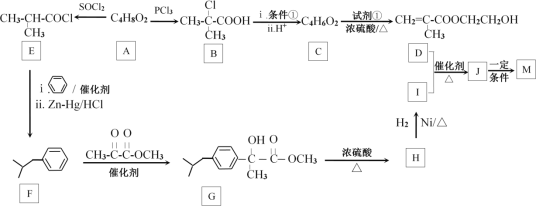
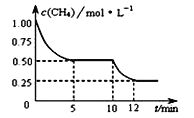
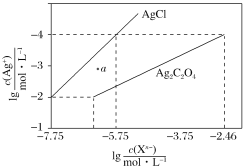
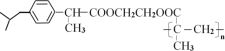题目内容
【题目】海水是可以综合利用的。从海水中提取食盐和溴的过程如下:
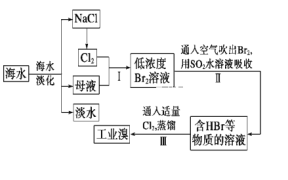
(1)请写出一种海水淡化的方法:__。
(2)步骤Ⅰ获取Br2的离子方程式为___。
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是__(填化学式)。若反应中生成2molHBr,则消耗___molSO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是__。
【答案】蒸馏法 Cl2+2Br-=Br2+2Cl- Br2 1 Cl2>Br2>SO2
【解析】
(1)海水淡化的方法很多,可以让海水中的金属及酸根离子离开,如通过离子交换剂;可以用电渗析法;也可用蒸馏法。
(2)步骤Ⅰ获取Br2的反应中氯气与溴离子发生反应。
(3)Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,Br2中的Br元素价态降低,SO2中的S元素价态升高,从反应式看,生成2molHBr,消耗1molSO2。
(4)SO2、Cl2、Br2三种物质氧化性关系,可利用反应中氧化剂的氧化性大于氧化产物的氧化性进行判断.
(1)海水淡化的方法:最常见的为蒸馏法。答案:蒸馏法;
(2)步骤Ⅰ获取Br2的离子方程式为Cl2+2Br-=Br2+2Cl-。答案为:Cl2+2Br-=Br2+2Cl-;
(3)在该反应Br2+SO2+2H2O=H2SO4+2HBr中,氧化剂是Br2;若反应中生成2molHBr,则消耗1molSO2。答案为:Br2;1;
(4)在反应Cl2+2Br-=Br2+2Cl-中,氧化性Cl2>Br2;在反应Br2+SO2+2H2O=H2SO4+2HBr中,氧化性Br2>SO2,所以SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是Cl2>Br2>SO2。答案为:Cl2>Br2>SO2。

 阅读快车系列答案
阅读快车系列答案【题目】相同温度下,体积均为0.25 L 的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.6kJ/mol.实验测得起始、平衡时的有关数据如表:
2NH3(g) ΔH=-92.6kJ/mol.实验测得起始、平衡时的有关数据如表:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.容器②中达平衡时放出的热量Q=23.15kJ
D.若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ