题目内容
【题目】汽车尾气的主要成分有CO、SO2、氮氧化物等,科学家们-直致力于污染物的有效消除。
(1)利用氨水可以将SO2、氮氧化物吸收,原理如下图所示。
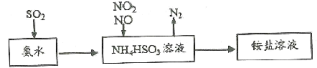
请写出NO2和NO按体积比1:1被吸收时反应的离子方程式_________________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①己知:2NO(g)+O2(g)=2NO2(g) △H1=-113.0kJ· mol-1
2SO2(g)+O2(g)=2SO3(l) △H2=-288.4kJ· mol-1
N2(g)+O2(g)![]() 2NO(g) △H3=+180.5kJ· mol-1
2NO(g) △H3=+180.5kJ· mol-1
请判断反应NO2(g)+SO2(g)=NO(g)+SO3(l) △H4,在低温下能否自发进行_______(填“能”或“否”),理由是__________________________。
②己知TiO2催化尾气降解原理为:
2CO(g)+O2(g)![]() 2CO2(g);2H2O(g)+4NO(g)+3O2(g)
2CO2(g);2H2O(g)+4NO(g)+3O2(g)![]() 4HNO3(g)
4HNO3(g)
i、在一定条件下,模拟CO、NO的降解,得到降解率(即转化率)随时间变化如图所示,
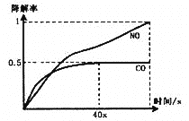
反应40秒后检测到混合气体中N2浓度上升,HNO3气体浓度有所降低,请用化学方程式并结合化学反应原理知识解释可能的原因____________________________________________。
ii,沥青混凝土也可降解CO。如图为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合图表回答下列问题:
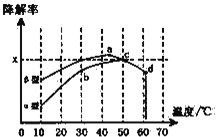
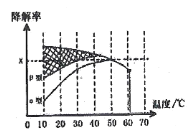
已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L-1,求此温度下CO降解反应的平衡常数____________________(用含x的代数式表示);以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10~60℃范围内进行实验,请在图中用线段与阴影,仿照“示例”描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(示例:![]() )_____________________。
)_____________________。
(3)利用如图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2,b极的电极反应式为_______________________________。

【答案】NO2+NO+3HSO3-=N2+3SO42-+3H+ 能 △H4= -87.7kJ· mol-1<0,根据方程式可判断反应的△S<0,故在低温时能自发进行 i发生反应2NO![]() N2+O2生成N2,NO浓度降低,平衡2H2O+4NO+3O2
N2+O2生成N2,NO浓度降低,平衡2H2O+4NO+3O2![]() 4HNO3逆向移动,HNO3浓度降低
4HNO3逆向移动,HNO3浓度降低 ![]()
 2HSO3-+2e-=S2O42-+2OH-(或2HSO3-+2e-+2H+=S2O42-+2H2O)
2HSO3-+2e-=S2O42-+2OH-(或2HSO3-+2e-+2H+=S2O42-+2H2O)
【解析】
(1)根据图中分析,反应物为NO、NO2、NH4HSO3,产物为N2,该反应为氧化还原反应,则SO42-一定也是产物,据此写出离子方程式;
(2)①先根据盖斯定律,计算出△H4,再根据△G=△H-T△S分析该反应能否自发进行,
②i、结合反应N2(g)+O2(g)![]() 2NO(g)、2H2O(g)+4NO(g)+3O2(g)
2NO(g)、2H2O(g)+4NO(g)+3O2(g)![]() 4HNO3(g)进行分析即可;
4HNO3(g)进行分析即可;
ii、列出反应的三段式,用x表示出各组分的浓度,再根据K=![]() 进行计算;题中说明TiO2纳米管的催化效果更好,则其CO降解率随温度变化的曲线应在β型曲线的上方,趋势和β型曲线相同;
进行计算;题中说明TiO2纳米管的催化效果更好,则其CO降解率随温度变化的曲线应在β型曲线的上方,趋势和β型曲线相同;
(3)b极上,HSO3-变为了S2O42-,S由+4价变为了+3价,则要得到电子,依此可写出电极方程式。
(1)根据图中分析,反应物为NO、NO2、NH4HSO3,产物有N2、SO42-,该反应的离子方程式为NO2+NO+3HSO3-=N2+3SO42-+3H+;
(2)①根据盖斯定律可得:△H4=![]() (-△H1+△H2)=
(-△H1+△H2)=![]() ×(113.0kJ·mol-1-228.4kJ·mol-1)= -87.7kJ· mol-1<0,而反应△S也小于0,故低温时△G=△H-T△S<0,该反应能自发进行;
×(113.0kJ·mol-1-228.4kJ·mol-1)= -87.7kJ· mol-1<0,而反应△S也小于0,故低温时△G=△H-T△S<0,该反应能自发进行;
②i、NO降解:2NO(g)![]() N2(g)+O2(g),N2的浓度升高,NO的浓度降低,使得平衡2H2O(g)+4NO(g)+3O2(g)
N2(g)+O2(g),N2的浓度升高,NO的浓度降低,使得平衡2H2O(g)+4NO(g)+3O2(g)![]() 4HNO3(g)逆向移动,HNO3的浓度也降低;
4HNO3(g)逆向移动,HNO3的浓度也降低;
ii、设CO的初始浓度为y mol·L-1,则反应的三段式为:
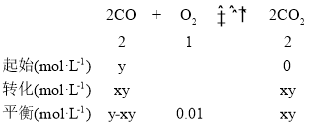 ,
,
K=![]() =
=![]() =
=![]() ;
;
题中说明TiO2纳米管的催化效果更好,则其CO降解率随温度变化的曲线应在β型曲线的上方,趋势和β型曲线相同,如下图所示:
 ;
;
(3)b极上,HSO3-变为了S2O42-,S由+4价变为了+3价,是得到电子的过程,则该电极反应方程式为:2HSO3-+2e-=S2O42-+2OH-。

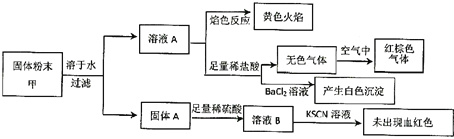
【题目】已知海水提取镁的主要步骤如下:
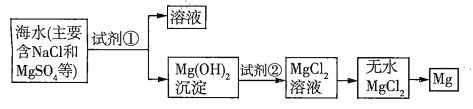
(1)关于加入试剂①作沉淀剂,有以下方法,请完成下列问题。
方法 | 是否合理 | 简述理由 |
方法:高温加热蒸发海水后,再加入沉淀剂 | a | b |
你认为合理的其他方法是c |
a. _____________;
b.____________;
c.____________。
(2)框图中加入的试剂①应该是_______(填物质名称),加入试剂②的溶质是_______(填化学式)。工业上由无水![]() 制取镁的化学方程式为___________。
制取镁的化学方程式为___________。
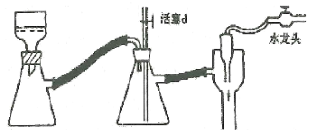
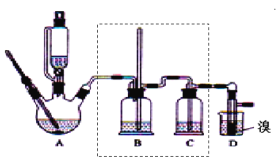
【题目】实验室制备1,2—二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2—二溴乙烷,装置如图所示。有关数据列表如表所示。回答下列问题:
乙醇 | 1,2—二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是__。
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置A中除了浓硫酸和乙醇外,还应加入__,其目的是__。装置A中生成副产物乙醚的化学反应方程式为__。
(3)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,为了验证SO2的存在并除去SO2对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放___。
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液 d.品红和酸性KMnO4
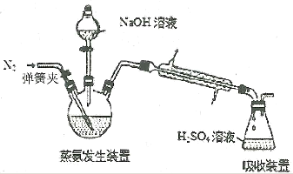
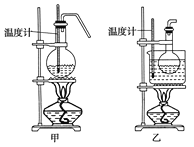
(4)甲、乙两装置均可用作实验室由无水乙醇制取乙烯,乙图采用甘油浴加热(甘油沸点290℃,熔点18.17℃),当甘油温度达到反应温度时,将盛有无水乙醇和浓硫酸混合液的烧瓶放入甘油中,很快达到反应温度。甲、乙两装置相比较,乙装置有哪些优点__,写出该实验中由无水乙醇制取乙烯的化学方程式___。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置后,产物应在__层;若产物中有少量副产物乙醚。可用__的方法除去。