题目内容
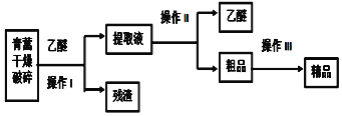
【题目】过碳酸钠(2Na2CO3·3H2O2)广泛用于化工、造纸、纺织、食品等行业,一种以芒硝(Na2SO4·10H2O)、H2O2等为原料制备过碳酸钠的工艺流程如下:
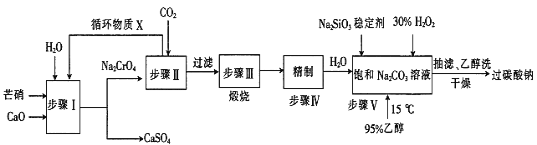
已知:2CrO42-+2H+![]() Cr2O72-+H2O,pH小于5时几乎均以Cr2O72-形式存在,pH大于8.5时几乎均以CrO42-形式存在。回答下列问题:
Cr2O72-+H2O,pH小于5时几乎均以Cr2O72-形式存在,pH大于8.5时几乎均以CrO42-形式存在。回答下列问题:
(1)由步骤I可知:Ksp(CaCrO4)_____Ksp(CaSO4)(填“>”或“<”)。
(2)流程中循环物质X的主要溶质为____________(填化学式)。
(3)步骤II后的溶液过滤得到一种酸式盐固体,其发生反应的离子方程式为________________。
(4)步骤III是为了制得纯碱,其化学方程式为 _________________________________。
(5)步骤V合成时,调节温度为15℃并加入95%乙醇的目的是____________________。
(6)测定产品活性氧的实验步骤如下:准确称取mg产品,用硫酸溶解后,用c mol· L-1的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液V mL。
①该滴定过程不需要外加指示剂的原因是_________________________________ 。
②滴定到终点时,溶液最终呈________(填“无色”或“浅红色”)。
【答案】> Na2Cr2O7 2Na++2CrO42-+2CO2+H2O=Cr2O72-+2NaHCO3↓ 2NaHCO3![]() Na2CO3+CO2↑+H2O↑ 减小过碳酸钠溶解度,促使其析出 KMnO4溶液本身有紫红色 浅红色
Na2CO3+CO2↑+H2O↑ 减小过碳酸钠溶解度,促使其析出 KMnO4溶液本身有紫红色 浅红色
【解析】
本题是一道工业流程题,用芒硝来制备过碳酸钠,据此来分析即可。步骤I分离出了不溶于水的![]() ,因此是过滤;步骤II向溶液中通入
,因此是过滤;步骤II向溶液中通入![]() 是为了得到
是为了得到![]() ,另一方面由于
,另一方面由于![]() 的水溶液为弱酸性,溶液中的铬元素以
的水溶液为弱酸性,溶液中的铬元素以![]() 的形式存在,因此溶液中还有
的形式存在,因此溶液中还有![]() ,可以循环利用。
,可以循环利用。![]() 在水中的溶解度不大,因此过滤后煅烧得到
在水中的溶解度不大,因此过滤后煅烧得到![]() ,碳酸钠精制后加水得到饱和碳酸钠溶液,再和双氧水进行氧化还原即可。加入95%乙醇的目的是为了降低产物的溶解度,使产物析出,本题得解。
,碳酸钠精制后加水得到饱和碳酸钠溶液,再和双氧水进行氧化还原即可。加入95%乙醇的目的是为了降低产物的溶解度,使产物析出,本题得解。
(1)根据沉淀的转化,溶解度高的沉淀可以转化为溶解度低的沉淀,因此![]() 大于
大于![]() ;
;
(2)根据分析,物质X为![]() ;
;
(3)根据分析,步骤II是通过通入![]() 来得到
来得到![]() ,此处的
,此处的![]() 因溶解度较低析出,使反应得以发生:
因溶解度较低析出,使反应得以发生:![]() ;
;
(4)煅烧![]() 使其分解即可得到纯碱:
使其分解即可得到纯碱:![]()
![]()
![]() ;
;
(5)根据分析,降温和加入极性介质均可降低产物在溶液中的溶解度,方便收集;
(6)①在做高锰酸钾相关的滴定时一般不需要加指示剂,因为高锰酸钾本身具有明显的紫红色 ;
②当达到滴定终点后,溶液中的活性氧已被消耗完,此时若再滴入高锰酸钾,就会过量,过量的高锰酸钾呈浅红色。

【题目】已知海水提取镁的主要步骤如下:
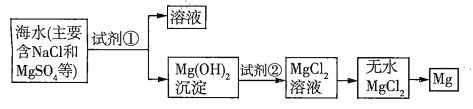
(1)关于加入试剂①作沉淀剂,有以下方法,请完成下列问题。
方法 | 是否合理 | 简述理由 |
方法:高温加热蒸发海水后,再加入沉淀剂 | a | b |
你认为合理的其他方法是c |
a. _____________;
b.____________;
c.____________。
(2)框图中加入的试剂①应该是_______(填物质名称),加入试剂②的溶质是_______(填化学式)。工业上由无水![]() 制取镁的化学方程式为___________。
制取镁的化学方程式为___________。