题目内容
4.W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属,Y、Z是非金属元素.用化学用语回答下列问题.(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(2)W与Y可形成化合物W2Y,该化合物的电子式为
 .
.(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl.
(4)比较Y、Z气态氢化物的稳定性:HCl>H2S.
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是S 2->Cl->Na+>Al3+.
(6)Z的最高价氧化物为无色液体,该物质与水可发生反应.写出该反应的化学方程式:Cl2O7+H2O=2HClO4.
分析 W、X、Y、Z是原子序数依次增大的同一周期元素,W、X是金属元素,Y、Z是非金属元素.
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,可推知W为Na、X为Al;
(2)W(Na)与Y可形成化合物W2Y,Y表现-2价,则Y为S;
(3)结合原子序数可知Z为Cl,S的低价氧化物通入氯气的水溶液中,应为二氧化硫与氯气反应生成硫酸与HCl;
(4)同周期自左而右元素非金属性增强,非金属性越强,氢化物越稳定;
(5)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大;
(6)Z的最高价氧化物为是Cl2O7,Cl2O7和水反应生成高氯酸.
解答 解:W、X、Y、Z是原子序数依次增大的同一周期元素,原子序数均小于18,W、X是金属元素,Y、Z是非金属元素.
(1)W、X为金属,其最高价氧化物对应的水化物为碱,且两种碱可以反应生成盐和水,则为NaOH和Al(OH)3,二者反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)W(Na)与Y可形成化合物W2Y,Y表现-2价,则Y为S,Na2S的电子式为: ,故答案为:
,故答案为: ;
;
(3)结合原子序数可知Z为Cl,S的低价氧化物通入氯气的水溶液中,应为二氧化硫与氯气反应生成硫酸与HCl,反应化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(4)同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物越稳定,所以稳定性为HCl>H2S,
故答案为:HCl;H2S;
(5)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故离子半径大小顺序是:S 2->Cl->Na+>Al3+,
故答案为:S 2-;Cl-;Na+;Al3+;
(6)Z的最高价氧化物为是Cl2O7,Cl2O7和水反应生成高氯酸,化学反应方程式为:Cl2O7+H2O=2HClO4,故答案为:Cl2O7+H2O=2HClO4.
点评 本题考查结构性质位置关系应用,涉及电子式、微粒半径比较、元素周期律应用、化学方程式书写等,正确推断元素是解本题关键,注意掌握微粒半径大小的比较方法.

| A. | C2H4 | B. | NaOH | C. | MgCl2 | D. | HCl |
| A. | NaOH碱性比KOH强 | |
| B. | Li是最活泼的金属,F是最活泼的非金属 | |
| C. | X2+核外电子数目为18,则X在第四周期第ⅡA族 | |
| D. | 元素周期表有7个副族,7个主族,1个0族,1个Ⅷ族,共16个纵行 |
| A. | mol/L | B. | mol/S | C. | mol/L•S | D. | mol/(L•min) |
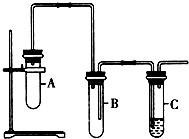 已知1,2-二氯乙烷常温下为无色液体,沸点83.5℃,密度1.23g/mL,难溶于水,易溶于醇、醚、丙酮等有机溶剂.乙醇的沸点为78.5℃.某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图实验装置.请回答下列问题.
已知1,2-二氯乙烷常温下为无色液体,沸点83.5℃,密度1.23g/mL,难溶于水,易溶于醇、醚、丙酮等有机溶剂.乙醇的沸点为78.5℃.某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图实验装置.请回答下列问题.