题目内容
9.海水的综合利用可以制备金属镁,其流程如图所示: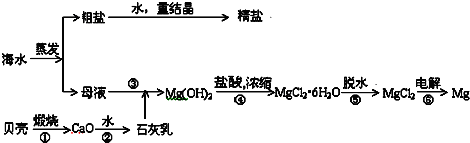
(1)写出①、⑥反应的化学方程式:①CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,⑥MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(2)在反应①→⑥中属于氧化还原反应的是⑥ (填写标号作答).
(3)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤.在混合物中加入MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤.
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;溶解时:搅拌,加速溶解.过滤时:引流,使待滤液体沿玻璃棒流入漏斗,防止外洒.蒸发时:搅拌,防止因局部温度过高而导至液滴或晶体飞溅.
分析 流程分析海水蒸发得到氯化钠和母液,粗盐提纯得到精盐,母液加入由贝壳得到的氢氧化钙沉淀镁离子,过滤得到氢氧化镁沉淀,用盐酸溶解后浓缩蒸发得到氯化镁晶体,以防止镁离子水解,在氯化氢气流中加热失水得到固体氯化镁,通过电解得到金属镁;
(1)贝壳成分为碳酸钙,加热分解生成的氧化钙和二氧化碳,电解熔融的氯化镁可得镁和氯气;
(2)根据反应①→⑥中元素化合价的变化情况判断氧化还原反应;
(3)根据沉淀的溶解平衡原理,在溶液中加入过量的镁离子,可以将Ca(OH)2转化为Mg(OH)2沉淀;
(4)溶解时为加快溶解、过滤时为防止液体外洒、冲破滤纸而引流、蒸发时为防止液体溅出都要使用玻璃棒.
解答 解:流程分析海水蒸发得到氯化钠和母液,粗盐提纯得到精盐,母液加入由贝壳得到的氢氧化钙沉淀镁离子,过滤得到氢氧化镁沉淀,用盐酸溶解后浓缩蒸发得到氯化镁晶体,以防止镁离子水解,在氯化氢气流中加热失水得到固体氯化镁,通过电解得到金属镁;
(1)反应①为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,反应⑥为MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
(2)反应①为碳酸钙受热分解,反应②为氧化钙与水反应生成氢氧化钙,反应③为镁离子生成氢氧化镁沉淀,反应④为氢氧化镁溶于盐酸,反应⑤为氯化镁晶体失去结晶水,这些反应中各元素的化合价都没有变化,都是非氧化还原反应,反应为⑥为电解氯化镁生成氯气和镁,元素的化合价发生变化,是氧化还原反应,
故答案为:⑥;
(3)根据沉淀的转化原理,除去Mg(OH)2沉淀中的Ca(OH)2可以在混合物中加入MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤,
故答案为:在混合物中加入MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤;
(4)溶解时为加快溶解、过滤时为防止液体外洒、冲破滤纸而引流、蒸发时为防止液体溅出都要使用玻璃棒,
故答案为:搅拌,加速溶解;引流,使待滤液体沿玻璃棒流入漏斗,防止外洒;搅拌,防止因局部温度过高而导至液滴或晶体飞溅.
点评 本题考查海水的综合利用,涉及金属制备、元素化合物性质、常用化学用语等,难度不大,掌握流程原理是解题关键.

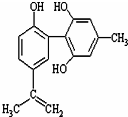 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )| A. | 该物质的分子式为C16H15O3 | |
| B. | 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 | |
| C. | 该分子中的所有碳原子不可能共平面 | |
| D. | 1mol此物质分别与浓溴水和H2反应时最多消耗Br2和H2为4mol 和7mol |
| A. | 甲烷和乙烷 | B. | CH4与CH3-CH2-CH3 | ||
| C. | CH3-CH2-CH2-CH3 与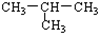 | D. | 苯与环己烷 |
 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式. .
.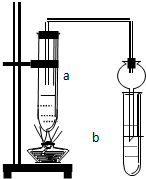 如图所示,在试管a中先加2mL乙醇,边摇动边缓缓加入5mL浓硫酸,摇匀冷却后,再加入2g无水醋酸钠,充分搅动后,固定在铁架台上.在试管b中加入适量的饱和Na2CO3溶液.连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验.
如图所示,在试管a中先加2mL乙醇,边摇动边缓缓加入5mL浓硫酸,摇匀冷却后,再加入2g无水醋酸钠,充分搅动后,固定在铁架台上.在试管b中加入适量的饱和Na2CO3溶液.连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验.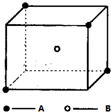 某离子晶体晶胞结构如图所示,A位于立方体的顶点,B位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,A位于立方体的顶点,B位于立方体中心.试分析: