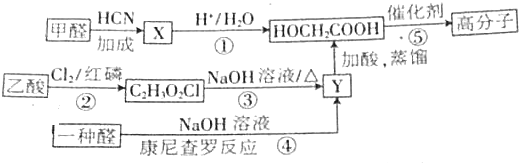
题目内容
13.1mol碘化亚铁与足量氯气反应时转移的电子数为3×6.02×1023,反应的方程式为2FeI2+3Cl2=2FeCl3+2I2.分析 氯气可以氧化亚铁离子、碘离子,反应方程式为:2FeI2+3Cl2=2FeCl3+2I2,根据方程式计算参加反应氯气物质的量,再根据Cl元素化合价变化计算转移电子.
解答 解:氯气可以氧化亚铁离子、碘离子,反应方程式为:2FeI2+3Cl2=2FeCl3+2I2,1molFeI2反应需要Cl2的物质的量为1mol×$\frac{3}{2}$=1.5mol,反应中Cl元素化合价由0价降低为-1价,故转移电子为1.5mol×2=3mol,即转移电子数为3×6.02×1023个,
故答案为:3×6.02×1023;2FeI2+3Cl2=2FeCl3+2I2.
点评 本题考查氧化还原反应方程式书写及电子转移计算,比较基础,明确发生的反应是关键.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
3.下表为元素周期表的一部分,参照元素①~⑫在表中的位置,请回答下列问题.
(1)画出⑦的离子结构示意图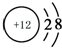 .
.
(2)⑤、⑥、⑪的原子中半径最大的是⑥(写编号).
(3)⑥和⑧的最高价的氧化物的水化物中碱性弱些的是Al(OH)3.(填化学式)
(4)④、⑩的气态氢化物中的稳定性强些的是H2O.(填化学式)
(5)写出②和⑫组成的各原子最外层电子都满足8电子的物质的化学式CCl4.
(6)写出一种由①④组成且含有非极性键的物质的电子式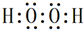 .
.
(7)③的最高价含氧酸的稀溶液与铜粉反应的离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(8)利用较强酸能制出较弱酸的原理,写出一个能证明②和⑨非金属性强弱的一个常见反应的化学方程式Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
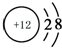 .
.(2)⑤、⑥、⑪的原子中半径最大的是⑥(写编号).
(3)⑥和⑧的最高价的氧化物的水化物中碱性弱些的是Al(OH)3.(填化学式)
(4)④、⑩的气态氢化物中的稳定性强些的是H2O.(填化学式)
(5)写出②和⑫组成的各原子最外层电子都满足8电子的物质的化学式CCl4.
(6)写出一种由①④组成且含有非极性键的物质的电子式
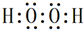 .
.(7)③的最高价含氧酸的稀溶液与铜粉反应的离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(8)利用较强酸能制出较弱酸的原理,写出一个能证明②和⑨非金属性强弱的一个常见反应的化学方程式Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3.
5.某地有甲、乙两工厂排放污水,污水中各存在下列8种离子中的4种(两厂不含大量相同的离子):Ba2+、Fe3+、OH-、SO42-、Ag+、NO3-、Cl-、Na+,两厂的污水单独排放都会造成严重的水污染,若将两厂的污水按一定比例混合,沉淀后污水便只含硝酸钠而变得无色澄清,污染程度大大降低,关于污染源的分析,你认为正确的是( )
| A. | SO42-和NO3-可能来自同一工厂 | B. | Cl-和NO3-一定不在同一工厂 | ||
| C. | Ag+和Na+可能来自同一工厂 | D. | Na+和NO3-来自同一工厂 |
4.下列有关金属及其化合物的说法正确的是( )
| A. | 铜粉与稀硫酸不反应,但加入一定量硝酸钠后铜粉会发生溶解 | |
| B. | 金属Na久置于空气中最终产物是生成Na2O2 | |
| C. | Mg比Al活泼,更易与NaOH溶液反应生成H2 | |
| D. | 水蒸气通过灼热的铁粉有红棕色固体生成 |
 .
.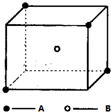 某离子晶体晶胞结构如图所示,A位于立方体的顶点,B位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,A位于立方体的顶点,B位于立方体中心.试分析: