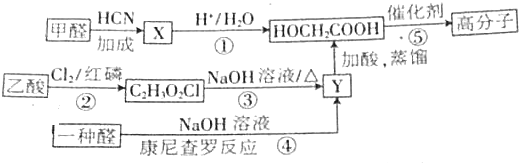
题目内容
16.今有CH4、HCHO、O2三种成分的混合气体,同温同压下与乙烷气体的密度相同.问:(1)混合气体中CH4和O2的物质的量之比为多少?
(2)若某条件下水为气态,气体的摩尔体积为50L/mol,在该条件下点燃混合气体,混合气恰好完全燃烧,共生成CO2 13.2g,求原混合气体中氧气的物质的量和生成的混合气体在该条件下的密度.
分析 (1)同温同压下,气体密度之比等于其摩尔质量之比,混合气体密度与乙烷密度相同,说明混合气体平均摩尔质量是30g/mol,甲醛的摩尔质量是30g/mol,所以混合气体与甲醛的物质的量多少无关,则甲烷和氧气的平均摩尔质量为30g/mol;
(2)nCO2=$\frac{13.2}{44}$mol=0.3mol,因为甲烷和氧气的物质的量之比为1:7,设原有CH4 xmol,根据C原子守恒得nHCHO=(0.3-x)mol,nO2=7x mol,
CH4完全燃烧时:
CH4~2O2
x 2x
HCHO完全燃烧时:
HCHO~O2
0.3-x 0.3-x
2x+0.3-x=7x
x=0.05,nO2=7x=0.35mol,又 CH4、HCHO燃烧前后△ng=0(H2O为气态),反应前后平均分子量不变,根据ρ=$\frac{M}{{V}_{m}}$进行计算.
解答 解:(1)同温同压下,气体密度之比等于其摩尔质量之比,混合气体密度与乙烷密度相同,说明混合气体平均摩尔质量是30g/mol,甲醛的摩尔质量是30g/mol,所以混合气体与甲醛的物质的量多少无关,则甲烷和氧气的平均摩尔质量为30g/mol,
设甲烷的物质的量是amol、氧气的物质的量是bmol,其平均摩尔质量=$\frac{16ag+32bg}{(a+b)mol}$=30g/mol
a:b=1:7,
答:混合气中nCH4:nO2=1:7;
(2)nCO2=$\frac{13.2}{44}$=0.3(mol)
设原有CH4 xmol,则nHCHO=(0.3-x)mol,nO2=7x mol.
CH4完全燃烧时:
CH4~2O2
x 2x
HCHO完全燃烧时:
HCHO~O2
0.3-x 0.3-x
2x+0.3-x=7x
x=0.05(mol)
nO2=7x=0.35 mol.
又 CH4、HCHO燃烧前后△ng=0(H2O为气态),反应前后平均分子量不变,
又∵$\overline M$=30,根据ρ═$\frac{\overline M}{50}$=$\frac{30}{50}$g/L=g/L,
答:原混合气体中氧气的物质的量和生成的混合气体在该条件下的密度是0.6g/L.
点评 本题考查混合物的有关计算,侧重考查学生分析计算能力,(1)中正确判断甲醛的量与不影响混合物密度是解该题关键,难点是(2)题计算,注意密度与摩尔质量、气体摩尔体积关系,题目难度中等.

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案| A. | 氯丁烷 | B. | 甲苯 | C. | 硝基苯 | D. | 乙酸 |

| A. | 1mol迷失香酸最多能和含6molNaOH的水溶液完全反应 | |
| B. | 1mol迷迭香酸最多能和9mol氢气发生加成,和6mol溴发生取代反应 | |
| C. | 迷迭香酸属于芳香烃 | |
| D. | 迷迭香酸可以发生水解、消去、取代和酯化反应 |
| A. | SO42-和NO3-可能来自同一工厂 | B. | Cl-和NO3-一定不在同一工厂 | ||
| C. | Ag+和Na+可能来自同一工厂 | D. | Na+和NO3-来自同一工厂 |
| A. | 原子核内有l8个中子的氯原子:${\;}_{17}^{35}$Cl | |
| B. | S2-的结构示意图: | |
| C. | CO2分子比例模型: | |
| D. | H2O2的电子式: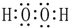 |
 .
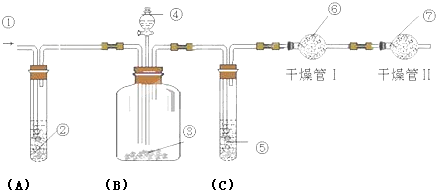
.
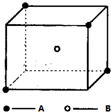 某离子晶体晶胞结构如图所示,A位于立方体的顶点,B位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,A位于立方体的顶点,B位于立方体中心.试分析: